Khử hoàn toàn 11,6 gam oxit sắt bằng CO dư, sản phẩm khí sinh ra dẫn vào dung dịch Ca(OH)2 dư thu được 20 gam kết tủa. Công thức oxit sắt là:
A. FeO
B. Fe2O3
C. Fe3O4
D. Không xác định
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cách khác:
\(Đặt.CTTQ: Fe_xO_y\left(x,y:nguyên,dương\right)\\ y=n_{CO}=n_{CO_2}=n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)\\ x=n_{Fe}=\dfrac{11,6-0,2.16}{2}=0,15\left(mol\right)\\ \Rightarrow x:y=0,15:0,2=3 :4\\ \Rightarrow x=3;y=4\\ \Rightarrow CTHH:Fe_3O_4\\ \Rightarrow B\)

Oxit sắt : FexOy
\(CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O\\ n_{CO_2} = n_{CaCO_3} =\dfrac{22,5}{100} = 0,225(mol)\\ Fe_xO_y + yCO \xrightarrow{t^o} xFe + yCO_2\\ n_{oxit} = \dfrac{n_{CO_2}}{y} = \dfrac{0,225}{y}(mol)\\ \Rightarrow \dfrac{0,225}{y}(56x + 16y) = 12\\ \Rightarrow \dfrac{x}{y} = \dfrac{2}{3}\)
Vậy CTHH của oxit : Fe2O3

a)
CTHH: FexOy
\(n_{Fe_xO_y}=\dfrac{16}{56x+16y}\left(mol\right)\)
PTHH: FexOy + yCO --to--> xFe + yCO2
\(\dfrac{16}{56x+16y}\)--------->\(\dfrac{16x}{56x+16y}\)
=> \(\dfrac{16x}{56x+16y}.56=16-4,8=11,2\)
=> \(\dfrac{x}{y}=\dfrac{2}{3}\Rightarrow Fe_2O_3\)
\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
PTHH: Fe2O3 + 3CO --to--> 2Fe + 3CO2
0,1------>0,3--------------->0,3
Ca(OH)2 + CO2 --> CaCO3 + H2O
0,3----->0,3
=> \(m_{CaCO_3}=0,3.100=30\left(g\right)\)
b) nCO (thực tế) = 0,3.110% = 0,33(mol)
=> VCO = 0,33.22,4 = 7,392(l)

Đáp án A
Phản ứng:
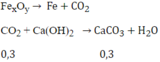
![]()
Cứ 0,1 mol có 0,3 mol nguyên tử O ⇒ y = 3 ⇒ x = 2
Công thức của oxit là Fe2O3

`a)`
Oxit: `Fe_xO_y`
`Fe_xO_y+yCO` $\xrightarrow{t^o}$ `xFe+yCO_2`
`CO_2+Ca(OH)_2->CaCO_3+H_2O`
Theo PT: `n_{CO_2}=n_{CaCO_3}=7/{100}=0,07(mol)`
`->n_{Fe_xO_y}={n_{CO_2}}/y={0,07}/y(mol)`
`->M_{Fe_xO_y}={4,06}/{{0,07}/y}=58y`
`->56x+16y=58y`
`->x/y={42}/{56}=3/4`
`->` Oxit: `Fe_3O_4`
`b)`
`n_{Fe_3O_4}={4,06}/{232}=0,0175(mol)`
`2Fe_3O_4+10H_2SO_4->3Fe_2(SO_4)_3+SO_2+10H_2O`
Đề thiếu.

Đáp án C
nCO2 = nCaCO3 = 0,07 mol
O + CO → CO2
0,07 ← 0,07
mKL = moxit – mO
= 4,06 – 0,07.16 = 2,94 (g)
Gọi hóa trị của KL khi tác dụng với HCl là n
M → 0,5n H2
0,105/n← 0,0525 (mol)
![]()
![]()
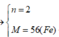
![]()
![]()

$CO + O_{oxit} \to CO_2$
$CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
$n_{O(oxit)} = n_{CaCO_3} = \dfrac{8}{100} = 0,08(mol)$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$n_{Fe} = n_{H_2} = \dfrac{1,344}{22,4} = 0,06(mol)$
Ta có :
$n_{Fe} : n_O = 0,06 : 0,08 = 3 : 4$
Vậy oxit là $Fe_3O_4$
Công thức oxit sắt có dạng: \(Fe_xO_y\)
\(Fe_xO_y+yCO\rightarrow xFe+yCO_2\uparrow\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(\Rightarrow n_{Fe}=n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\)
\(\Rightarrow n_{CO}=n_{CO_2}=n_{CaCO_3}=0,08\left(mol\right)\)
\(\Rightarrow n_{O\left(Fe_xO_y\right)}=n_{O\left(CO_2\right)}-n_{O\left(CO\right)}=2n_{CO_2}-n_{CO}=0,08\left(mol\right)\)
\(\Rightarrow n_{Fe}:n_O=0,06:0,08=3:4\)
\(\Rightarrow Fe_3O_4\)

a) nCaCO3 = 0.3 (mol)
CO + O => CO2
=> nO = 0.3 (mol)
mFe = moxit - mO = 16 - 0.3*16 = 11.2 (g)
nFe = 11.2/56 = 0.2 (mol)
nFe : nO = 0.2 : 0.3 = 2 : 3
CT oxit : Fe2O3
Đáp án C