Cho từ từ 200 ml dung dịch hỗn hợp Na2CO3 0,2 M và KHCO3 x M vào 200 ml dung dịch HCl 0,375 M, sau phản ứng thu được 1,008 lít CO2 ở (đktc). Giá trị của x là
A. 0,075M.
B. 0,2M.
C. 0,1M.
D. 0,025M.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
![]()
Cho từ từ đến X vào 0,02 ml HCl thu được 0,015 mol khí CO2
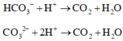
Giải được số mol HCO3- và CO32- phản ứng là 0,1 và 0,05 mol.
Do vậy trong X HCO3- và CO32- có tỉ lệ số mol là 2:1.
Vì còn CO32- nên kết tủa thu được là BaCO3 0,02 mol.
X chứa NaHCO3 và Na2CO3 với số mol lần lượt là 0,02 và 0,01 mol.
![]()

Đáp án D
nK2CO3 = nCO3 2- = 0,15.0,1 = 0,015 mol ; nNaHCO3 = nHCO3- = 0,15.0,2 = 0,03 mol
Do ban đầu H+ rất dư so với muối nên 2 muối đều phản ứng đồng thời
CO32- + 2H+ → CO2 + H2O
HCO3- + H+ → CO2 + H2O
=> nCO3 pứ: nHCO3 pứ = 0,015: 0,03 = 1: 2 = x: 2x
nHCl = 0,2.0,2 = 0,04 mol = 2.x + 1.2x = 4x => x = 0,01 mol
=> nCO2 = x + 2x = 3x = 0,03 mol
=> VCO2 = 0,03.22,4 = 0,672 lít = 672 ml

Chọn C.
- Xét đồ thị :
+ Tại vị trí không thoát khí thì : n C O 3 2 - = n H + - n C O 2 = 0 , 16 m o l ⇒ n H C O 3 - = n C O 2 - n C O 3 2 - = 0 , 12 m o l
+ Vậy dung dịch X chứa 0,16 mol Na2CO3 và 0,12 mol NaHCO3
- Khi cho dung dịch X tác dụng với dung dịch chứa HCl (0,16 mol) và H2SO4 (0,2a mol) thì :
n H C l + n H 2 S O 4 = n C O 2 + n C O 3 2 - → 0 , 16 + 2 . 0 , 2 a = 0 , 16 + 0 , 08 ⇒ a = 0 , 2
- Cho Y tác dụng với Ba(OH)2 dư thì: n B a C O 3 = n C O 3 2 - + n H C O 3 - - n C O 2 = 0 , 2 m o l và n B a S O 4 = n H 2 S O 4 = 0 , 04 m o l .
Vậy m k t u a = 197 n B a C O 3 + 233 n B a S O 4 = 48 , 72 g a m
Đáp án C
Định hướng tư duy giải