Trộn ba dung dịch: HCl 0,2M; 0,1M và 0,08M với thể tích bằng nhau thu được dung dịch X. Cho 150 ml X tác dụng với 150 ml dung dịch hỗn hợp NaOH 0,1M và KOH 0,058M thu được dung dịch Y có pH = x. Giá trị của x là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
2 dung dịch có thể tích bằng nhau ⇒ nOH-/ Ba(OH)2 = 2nH+/ HCl
H+ + OH- → H2O
0,2V 0,4V (mol)
Phản ứng : 0,2V → 0,2V (mol)
⇒ Trong dung dịch thu được có OH- dư
Trộn 2 dung dịch có cùng thể tích ⇒ [OH-] dư = 0,2 : 2 = 0,1M
⇒ pH = 13.
Đáp án C.

Chọn đáp án D
Cần thật thật chú ý là trộn 3 thể tích bằng nhau các dung dịch
⇒ tạo 300 ml dung dịch X gồm 100 mL HCl 0,3M; 100 mL H2SO4 0,2M và 100 mL H3PO4 0,1M ||⇒
![]() mol.
mol.
V mL dung dịch Y gồm 2x mol NaOH và x mol Ba(OH)2
⇒ ![]() x mol.
x mol.
Phản ứng trung hòa:
![]()
⇒ 4x = 0,1 ⇒ x = 0,025 mol ⇒ V = n ÷ CM = 0,025 ÷ 0,1 = 0,25 lít ⇔ 250 mL.
⇒ chọn đáp án D.

- Trong 300 ml dung dịch X:
\(\text{nHCl = 0,3.0,3 = 0,09 mol}\)
\(\text{nH2SO4 = 0,2.0,3 = 0,06 mol}\)
\(\text{nH3PO4 = 0,1.0,3 = 0,03 mol}\)
-Trong V ml dung dịch Y chứa:
\(\text{nNaOH = 0,1.0,001V = 0,0001V (mol)}\)
\(\text{nBa(OH)2 = 0,2.0,001V = 0,0002V (mol)}\)
Phản ứng trung hòa tổng quát: b HaX + a M(OH)b → MaXb + ab H2O
Từ pư tổng quát ta thấy: nH = nOH
\(\text{+ BTNT "H": nH = nHCl + 2nH2SO4 + 3nH3PO4}\)
\(\text{+ BTNT "OH": nOH = nNaOH + 2nBa(OH)2}\)
=> nHCl + 2nH2SO4 + 3nH3PO4 = nNaOH + 2nBa(OH)2
=> 0,09 + 2.0,06 + 3.0,03 = 0,0001V + 2.0,0002V
=> V = 600 ml

Đáp án A
nH+= nHCl+ 2nH2SO4+ 3nH3PO4= 0,1.0,3+ 2.0,2.0,1+ 3.0,1.0,1=0,1 mol
nOH-= (V.0,1+2.0,2.V)/1000 mol
H+ + OH-→ H2O
Theo PT: nH+= nOH- nên 0,1=(V.0,1+2.0,2.V)/1000 suy ra V= 200 ml
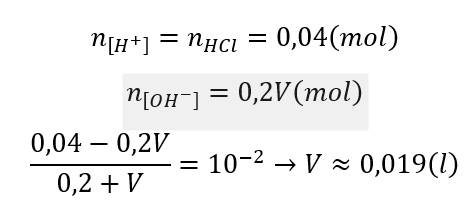

Chọn D
Trộn 3 dung dịch với thể tích bằng nhau thu được 150 ml dung dịch X → mỗi dung dịch lấy 50ml.
→ n H + = 0,05.0,2 + 0,05.2.0,1 + 0,05.0,08 = 0,024 mol.