Nhúng một miếng đồng vào dung dịch chứa 100 ml AgNO3 0,3M. Sau một thời gian lấy miếng đồng ra thấy khối lượng tăng lên 1,52 gam. Vậy nồng độ của AgNO3 sau phản ứng là:
A. 0,1M
B. 0,2M
C. 0,5M
D. 0,04M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Số mol CuSO4 ban đầu là 0,2 mol
Gọi a là số mol Fe phản ứng:
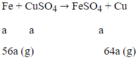
Khối lượng định sắt tăng lên là: 64a - 56a = 8a
Ta có: 8a = 0,4 → a = 0,05 mol
Số mol CuSO4 dư = 0,2 - 0,05 = 0,15 mol → [CuSO4]= 0,75M

Đáp án A
Phương trình phản ứng:

Ta có: Δm↑ = 64a - 56a = 1,2
→a = 0,15 mol
![]()

Đáp án A
Phương trình phản ứng:

Ta có: Δm↑ = 64a - 56a = 1,2
a = 0,15 mol


Đáp án A
Phương trình phản ứng:
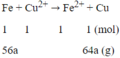
Ta có: Δm↑ = 64a - 56a = 1,2
a = 0,15 mol


Đáp án A
Phương trình phản ứng:
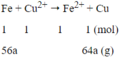
Ta có: Δm↑ = 64a - 56a = 1,2
a = 0,15 mol
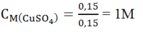

Đáp án B
Khối lượng AgNO3 = 250.4/100 = 10 (g)
Khối lượng AgNO3 trong dung dịch giảm 17% = khối lượng AgNO3 phản ứng = 1,7 (g)
⇒ Số mol AgNO3 = 0,01 mol
Phương trình phản ứng:
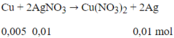
Khối lượng vật bằng Cu = 10 - 0,005.64 + 0,01.108 = 10,76 (g)

Đáp án B
Khối lượng AgNO3 = 250.4/100 = 10 (g)
Khối lượng AgNO3 trong dung dịch giảm 17% = khối lượng AgNO3 phản ứng = 1,7 (g)
⇒Số mol AgNO3 = 0,01 mol
Phương trình phản ứng:
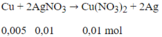
Khối lượng vật bằng Cu = 10 - 0,005.64 + 0,01.108 = 10,76 (g)

Đáp án C
Ta có:
![]()
Khối lượng AgNO3 giảm đi 25% chính là lượng AgNO3 phản ứng.
Vậy:
![]()
Phản ứng:
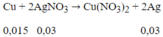
mvật = 15 + (0,03.108 - 0,015.64) = 17,28 (g)

Đáp án C
Phương trình phản ứng:
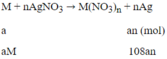
Khối lượng thanh thứ nhất tăng 151%:
108an - aM = 1,51 (1)

Khối lượng thanh thứ 2 giảm:
aM - 32an = 0,01 (2)
Tổ hợp (1) và (2) ta được: aM = 0,65; an = 0,02
⇒ Chọn M = 32,5n
Khi n = 2 thì M = 65
Vậy M =Zn
Đáp án A
Số mol AgNO3 = 0,03 (mol)
Phương trình phản ứng:
Ta có: 108.2a - 64a = 152a = 1,52 → a = 0,01 (mol)
Số mol AgNO3 còn lại = 0,03 -2.a = 0,03 - 2.0,01 = 0,01 mol
Nồng độ AgNO3 = 0,01/0,1 = 0,1M