Đối với dung dịch axit mạnh HNO3 0,1M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. [H+] = 0,1M.
B. [H+] < [NO3-].
C. [H+] > [NO3-].
D. [H+] < 0,1M.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

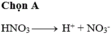

- Đáp án A
- Do HNO3 là chất điện li mạnh nên nó phân li hoàn toàn trong dung dịch
HNO3 → H+ + NO3-
0,1 0,1 0,1 (M)
⇒ [H+ ] = [NO3- ] = 0,1M

HNO3 → H+ + NO3-
Do phân li hoàn toàn ⇒ [H+] = 0,1M
Đáp án A

CH3COOH ⇄ H+ + CH3COO-
Do phân li không hoàn toàn → [H+] < 0,1M
Đáp án D

Chọn đáp án B
CH3COOH là chất điện li yếu: CH3COOH ⇄ CH3COO– + H+
⇒ [H+] = [CH3COO–] = [CH3COOH]điện li < [CH3COOH]ban đầu = 0,1M

Chọn đáp án B
CH3COOH là chất điện li yếu: CH3COOH ⇄ CH3COO– + H+
⇒ [H+] = [CH3COO–] = [CH3COOH]điện li < [CH3COOH]ban đầu = 0,1M
⇒ chọn B.