Đốt cháy hòan tòan 7,2 gam kim loại M (có hóa trị hai không đổi trong hợp chất) trong hh khí C12 và O2. Sau phản ứng thu được 23,0 gam chất rắn và thể tích hh khí đã pư 1à 5,6 lít (ở đktc). Kim 1oại M 1à
A. Mg
B. Ca
C. Be
D. Cu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn A
Cách 1:
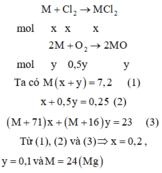
Cách 2:
Gọi số mol của Cl2 và O2 phản ứng lần lượt là x và y mol
→ nkhí = 0,25 mol → x + y = 0,25 (1)
Bảo toàn khối lượng có mkhí= 23 – 7,2= 15,8 gam
→ 71x + 32y = 15,8 (2)
Từ (1) và (2) → x = 0,2 và y = 0,05
Bảo toàn electron có:
2.nM = 2.nCl2 + 4.nO2 → nM= 0,3 → MM = 7,2 : 0,3 = 24 (g/mol)
Vậy kim loại M là Mg.

Đáp án A
mrắn sau − mM = mX ⇒ 71nCl2 + 32nO2 = 23 − 7,2 = 15,8 g (1)
⇒nkhí = nCl2 +nO2 = 0,25 mol (2)
Giải hệ (1) và (2) ⇒nCl2 = 0,2; nO2 = 0,05 mol
Gọi hóa trị của M là x
Bảo toàn e

M = ![]() = 12x, x = 2 => M = 24 (Mg)
= 12x, x = 2 => M = 24 (Mg)

\(n_{Cl_2}=a\left(mol\right),n_{O_2}=b\left(mol\right)\)
\(n_{hh}=a+b=0.25\left(mol\right)\left(1\right)\)
BTKL :
\(m_{khí}=23-7.2=15.8\left(g\right)\)
\(\Rightarrow71a+32b=15.8\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.2,b=0.05\)
\(2M+nCl_2\underrightarrow{^{^{t^0}}}2MCl_n\)
\(4M+nO_2\underrightarrow{^{^{t^0}}}2M_2O_n\)
\(n_M=\dfrac{0.4}{n}+\dfrac{0.2}{n}=\dfrac{0.6}{n}\left(mol\right)\)
\(M_M=\dfrac{7.2}{\dfrac{0.6}{n}}=12n\)
\(n=2\Rightarrow M=24\)
\(M:Mg\)
Gọi $n_{Cl_2} = a ; n_{O_2} = b \Rightarrow a + b = 0,25(1)$
Bảo toàn khối lượng :
$7,2 + 71a + 32b = 23(2)$
Từ (1)(2) suy ra a = 0,2 ; b = 0,05
Gọi n là hóa trị M
$2M + nCl_2 \to 2MCl_n$
$4M + nO_2 \xrightarrow{t^o} 2M_2O_n$
Theo PTHH :
$n_M = \dfrac{2}{n}n_{Cl_2} + \dfrac{4}{n}n_{O_2} = \dfrac{0,6}{n}$
$\Rightarrow \dfrac{0,6}{n}.M = 7,2$
$\Rightarrow M = 12n$
Với n = 2 thì $M = 24(Magie)$
Đáp án A
Gọi số mol của C12 và O2 1ần lượt 1à x và y