Cho các dung dịch sau có cùng pH: HCl; NH4Cl; C6H5NH3Cl. Thứ tự tăng dần nồng độ mol/lít của các dung dịch là
A. HCl < NH4Cl < C6H5NH3Cl
B. HCl < C6H5NH3Cl < NH4Cl
C. C6H5NH3Cl < NH4Cl < HCl
D. NH4Cl < HCl < C6H5NH3Cl
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Không mất tính tổng quát, ta đặt:
![]()
Vì HCl là chất điện li mạnh nên ta có phương trình điện li như sau:
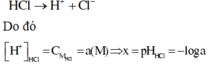
Vì CH3COOH là chất điện li yếu nên ta có phương trình điện li như sau
Xét cân bằng điện li: CH3COOH ⇌ CH3COO- + H+
Nồng độ ban đầu: aM 0
Nồng độ phân li: 0,01a M → 0,01a M
Nồng độ cân bằng: 0,99a M 0,01a M
Ta có
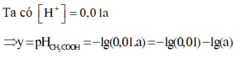
![]()
Đáp án A.
Đáp án : B
Cùng pH nghĩa là cùng số mol H+ phân li ra. Nồng độ mol càng cao, H+ phân li ra càng nhiều và axit càng mạnh, H+ cũng càng phân li ra nhiều.
Do đó HCl là axit mạnh nhất nên cũng phân li ra nhiều H+ nhất, do đó HCl có nồng độ thấp nhất => Loại C và D
C6H5NH3Cl có tính axit mạnh hơn NH4Cl do có nhóm C6H5-
=> thứ tự đúng là
HCl < C6H5NH3Cl < NH4Cl
=> Đáp án B