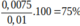Cho phản ứng . N2 + O2 ⇌ 2 NO có KC= 36. Biết rằng nồng độ ban đầu của N2 và O2 đều bằng 0,01 mol/l.Hiệu suất của phản ứng tạo NO là .
A. 75%
B. 80%
C. 50%
D. 40%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn D.
Gọi x là số mol của N2 và O2 tham gia phản ứng thì số mol còn lại của N2, O2 và tạo ra NO lần lượt là: (0,1 - x), (0,1 - x) và 2x.
Ta có: x=0,0075

\(\Delta_rH^{^o}_{298}=945+494-2\cdot607=+225kJ\\ \Rightarrow D\)
Bạn ơi, bạn có biết gì về Eb không vậy? Mình tính Eb(cđ) - Eb(sp) mà? Công thức đó đâu ra vậy?

`1>{1,2}/3->H` tính theo `H_2.`
Tại TTCB: `[H_2]=3/{2}[NH_3]=0,3M`
`->C_{H_2\ pu}=1,2-0,3=0,9M`
`->H={0,9}/{1,2}.100\%=75\%`
Không có đáp án đúng.
Đáp án A.
N2 + O2 ⇌ 2 NO
Ban đầu 0,01 0,01 (M)
Phản ứng x x 2x
Cân bằng 0,01-x 0,01-x 2x
H% =