Khi cho nhôm tác dụng với dung dịch H N O 3 loãng chỉ tạo ra sản phẩm khử là N H 4 N O 3 . Tổng các hệ số là số nguyên tối giản nhất trong phương trình hoá học của phản ứng xảy ra là
A. 74.
B. 58.
C. 76.
D. 68.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



560ml= 0,56l
gọi x ,y lần lượt là số mol của Mg và Al
pthh : 4Mg + 10HNO3 ---> 4 Mg(NO2)2 + N2O +5H2O(1)
x 1/4x
Al +6HNO3 ---> Al(NO3)3 + 3N2O + 3H2O(2)
y 3y
24x +27y= 1,86
ta có hệ phương trình :
1/4x + 3y = 0,56/ 22,4
giải hệ phương trình ta được x= 0,075 ,y=0,002
theo pthh (1) n Mg(NO3)2 = n Mg = 0,075 mol
_______(2) n Al(NO3)3 = n Al = 0,002 mol
---> m muối = m Mg(NO3)2 + m Al(NO3)3
= 0,075. 148 + 0,002 .213
=11,526(g)

Đáp án B
nCu = 1,92: 64 = 0,03 mol
Cu → Cu+2 + 2e
N+5 + 3e → N+2
Bảo toàn e: 2nCu = 3nNO => nNO = 2.0,03: 3 = 0,02 mol
=> VNO = 0,02. 22,4 = 0,448 lit

Đáp án B
Sắt và các hợp chất sắt có số oxi hóa nhỏ hơn +3 có khả năng tham gia phản ứng oxi hóa khử với dung dịch HNO3 loãng dư → có 6 chất thỏa mãn là: Fe, FeO, Fe3O4, Fe(OH)2, FeCO3, Fe(NO3)2.

Chọn đáp án D
Y có thể hoà tan được Cu và Fe sinh ra NO ⇒ Còn dư H+ và N O 3 - trong Y
⇒ Dung dịch Y gồm: Fe3+, H+, N O 3 - và S O 2 -

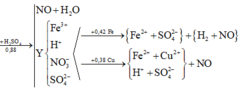
Y hoà tan tối đa 0,42 mol Fe nhưng chỉ hoà tan tối đa 0,38 mol Cu, sự chênh lệch này là do Cu không tác dụng với H+ tạo H2, đặt Z là dung dịch sau khi Y phản ứng với Cu


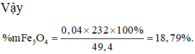

Đ á p á n A + X ↔ F e O ⇒ m X = 56 n F e + 16 n O 2 = 8 , 16 B T e : 3 n F e = 2 n O + 3 . n N O = 0 , 18 ⇒ n F e = 0 , 12 n O = 0 , 09 X é t t o à n q u á t r ì n h : F e → 0 F e + 2 B T e : 2 . n F e ⏟ 0 , 09 + 0 , 12 = 3 . n N O + 2 n O ⏟ 0 , 09 B T N T N : n H N O 3 = 2 n F e N O 3 2 + n N O ⇒ n N O = 0 , 08 n O = 0 , 5

Chọn C.
X → ← q u ỳ t í m F e O ⇒ 56 n F e + 16 n O = 8 , 16 3 n F e = 2 n O + 3 n O 0 , 06 ⇒ n F e = 0 , 12 n O = 0 , 09 2 n F e = 3 n O + 2 n O 0 , 09 + 0 , 12 ? 0 , 09 n H N O 3 = 2 n F e + n O n N O = 0 , 08 n H N O 3 = 0 , 5