Điện phân (điện cực trơ) dung dịch muối sunfua của một kim loại hóa trị II với dòng điện cường độ 3A. Sau khi 1930 giây điện phân thấy khối lượng catot tăng 1,92 gam. Xác định tên kim loại.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(a.Catot:M^{2+}+2e\rightarrow M\\ Anot:2H_2O\rightarrow4H^++O_2+4e\\ PTHH:2MSO_4+2H_2O-^{đp}\rightarrow2M+O_2+2H_2SO_4\\ b.m=\dfrac{AIt}{nF}=\dfrac{A.3.1930}{2.96500}=1,92\\ \Rightarrow A=64\left(Cu\right)\)

Đáp án A
Quá trình điện phân: M2+ + 2e → M
Có: ne = I.t/F = 3.1930/96500 = 0,06 mol
=> nM = ½ ne = 0,03 mol
=> MM = 1,92: 0,03 = 64 (g/mol) => Cu

bn sửa giúp mình câu b) nhé :'((((
sơ đồ là
Catot (-) <-------ZnCl2-------> Anot (+)
Zn2+ + 2e --> Zn 2Cl- --> Cl2 + 2e
a) Gọi CTHH của muối đó là XCl2
X+2 + 2e --> X
Có \(m=\dfrac{AIt}{nF}=\dfrac{M_X.5.1800}{2.96500}\)
=> \(M_X=65\left(Zn\right)\)
b)
Ở catot: Zn2+ + 2e --> Zn
Ở anot: 2Cl- --> Cl2 + 2e
\(ZnCl_2\underrightarrow{đpdd}Zn+Cl_2\)

Đáp án C
Dạng thời gian t, 2t kết hợp với khối lượng dung dịch giảm. ► quy cái này giải cho dễ này:
dung dịch giảm MO hay M2O hay M2O3 quy hết về dạng MnO nhé (n = 1 hoặc 2 hoặc 2/3 tùy).
• xét thời gian t (giây): dung dịch giảm x mol MnO ⇄ 6,96 gam → ne trao đổi = 2x mol.
thời gian 2t (giây) → ne trao đổi = 4x mol; catot ra 0,01 mol H2 → ứng với dung dịch ra 0,01 mol H2O.
→ 11,78 gam dung dịch giảm gồm 0,01 mol H2O và còn (2x – 0,01) mol MnO nữa.
→ Phương trình: 11,78 = 0,01 × 18 + 2 × 6,96 – 0,01 × MMnO → MnO = 232.
→ nM = 216 ứng với cặp n = 2 và M = 108 là kim loại Ag.
Thay ngược lại → x = 6,96 ÷ 232 = 0,03 mol → a = 6,48 gam
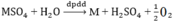

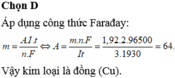

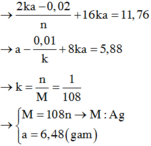
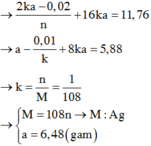
Theo định luật Faraday ta có khối lượng chất thoát ra ở điện cực là :
Trong đó A là nguyên tử khối
A = 64 ⇒ A là Cu