Trong một bình kín dung tích 10,0 lít chứa 21,0 g nitơ. Tính áp suất của khí trong bình, biết nhiệt độ của khí bằng 25 ° C .
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi n là số mol khí cacbonic chứa trong bình: n = m/ μ , trong đó M là khối lượng khí cacbonic có trong bình, μ là khối lượng mol của khí cacbonic.
Ta có n = 100 mol
Nếu gọi V 0 là thể tích của lượng khí cacbonic ở điều kiện chuẩn ( p 0 = 1,013. 10 5 Pa; T 0 = 273 K) thì V 0 = n v 0
Áp dụng phương trình trạng thái của khí lí tưởng cho lượng khí cacbonic:
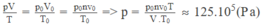

Do bình không dãn nở vì nhiệt, nên công do khí sinh ra : A' = p ∆ V = 0. Theo nguyên lí I, ta có :
∆ U = Q (1)
Nhiệt lượng do khí nhận được : Q = m c V ( T 2 - T 1 ) (2)
Mặt khác, do quá trình là đẳng tích nên :
![]()
Từ (2) tính được : Q = 15,58. 10 3 J.
Từ (1) suy ra: ∆ U = 15,58. 10 3 J.

Xét lượng khí trong bình.
Trạng thái đầu: V 1 = 8 lít; T 1 = 100 + 273 = 373 K ; p 1 = 10 5 N/ m 2
Trạng thái cuối: V 2 = 8 lít; T 2 = 20 + 273 = 293 K; p 2 = ?
Vì thể tích không đổi nên:
p 1 / T 1 = p 2 / T 2 ⇒ p 2 = p 1 T 2 / T 1 = 7,86. 10 4 N/ m 2

\(T_1=16^oC=16+273=289K\)
Tăng nhiệt độ khí trong bình lên 1,8 lần thì:
\(T_2=289\cdot1,8=520,2K\)
Áp dụng quá trình đẳng áp:
\(\dfrac{V_1}{T_1}=\dfrac{V_2}{T_2}\)
\(\Rightarrow\dfrac{20}{289}=\dfrac{V_2}{520,2}\)
\(\Rightarrow V_2=36l\)
T1=16oC=16+273=289KT1=16oC=16+273=289K
Tăng nhiệt độ khí trong bình lên 1,8 lần thì:
T2=289⋅1,8=520,2KT2=289⋅1,8=520,2K
Áp dụng quá trình đẳng áp:
V1T1=V2T2V1T1=V2T2
⇒20289=V2520,2⇒20289=V2520,2
⇒V2=36l

Gọi số quả bóng bay bơm được là \(n\left(quả\right)\)
Trạng thái đầu:
\(\left\{{}\begin{matrix}V_1=50l\\p_1=5MPa=5\cdot10^6Pa\\T_1=37^oC=310K\end{matrix}\right.\)
Trạng thái sau:
\(\left\{{}\begin{matrix}V_2=10n+50\left(l\right)\\p_2=1,05\cdot10^5Pa\\T_2=12^oC=285K\end{matrix}\right.\)
Phương trình trạng thái khí lí tưởng: \(\dfrac{p_1\cdot V_1}{T_1}=\dfrac{p_2\cdot V_2}{T_2}\)
\(\Rightarrow\dfrac{5\cdot10^6\cdot50}{310}=\dfrac{\left(10n+50\right)\cdot1,05\cdot10^5}{285}\)
\(\Rightarrow n=213quả\)

Cần tác dụng vào nắp một lực thằng được trọng lượng của nắp và lực gây ra bởi sự chênh lệch áp suất giữa không khí bên ngoài và bên trong bình:
F = mg + S( p 1 - p 2 ) = mg + π d 2 /4( p 1 - p 2 ) = 692N

Gọi số quả bóng bay bơm được là \(n\left(quả\right)\).
Trạng thái 1: \(\left\{{}\begin{matrix}p_1=5\cdot10^6Pa\\V_1=50l\\T_1=37^oC=310K\end{matrix}\right.\)
Trạng thái 2: \(\left\{{}\begin{matrix}p_2=1,05\cdot10^5Pa\\V_2=10n+50\left(l\right)\\T_2=12^oC=285K\end{matrix}\right.\)
Quá trình khí lí tưởng:
\(\dfrac{p_1V_1}{T_1}=\dfrac{p_2V_2}{T_2}\Rightarrow\dfrac{5\cdot10^6\cdot50}{310}=\dfrac{\left(1,05\cdot10^5\right)\cdot\left(10n+50\right)}{285}\)
\(\Rightarrow n\approx214quả\)

a)
Cứ N A phân tử (nguyên tử) He có khối lượng 4g.
Chú ý: N = 3 , 01.10 23 = N A 2
⇒ khối lượng He trong bình: m = 4 2 = 2 g
b)
Trong điều kiện nhiệt độ và áp suất như trên (ĐKTC),
thể tích của 1 mol He là V 0 = 22,1 lít. Vì lượng khí He
trong bình chỉ là 0,5 mol nên thể tích của bình là:
V = V 0 2 = 11 , 2 lít.

Chọn B.
Ban đầu, lúc chưa làm thoát khí ta có:
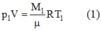
Khi làm thoát khí, lượng khí còn lại trong bình là
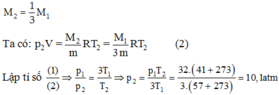
Cần áp dụng phương trình trạng thái khí pV = nRT, trong đó p là áp suất của khí trong bình kín (atm) ; V là thể tích của khí (lít), n là số mol khí trong thể tích V ; T là nhiệt độ tuyệt đối (K) với T = t( ° C ) + 273 ; R là hằng số lý tưởng, với trị số
Số mol khí N 2 :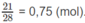
Áp suất của khí N 2 :