Cho 3,36 lít khí C O 2 (đktc) vào dung dịch chứa 500 ml KOH 0,1M và B a ( O H ) 2 0,12M kết thúc phản ứng thu được m gam kết tủa. Giá trị của m là
A. 2,55.
B. 3,94.
C. 1,97.
D. 4,925.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

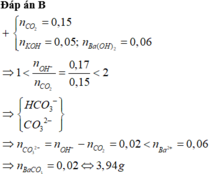

Chọn D
Ban đầu có nCO2 = 0,15 và tổng nOH– = 0,17 → 1 < nOH–/nCO2 < 2 → Tạo cả CO32– và HCO3–
→ nCO32– = nOH– – nCO2 = 0,17 – 0,15 =0,02 < 0,06 (nBa2+) → Tạo 0,02 BaCO3
Vậy m = 0,02 x 197 = 3,94.

Đáp án B
nCO2 = 0,15; nBa2+ = 0,06; nOH- = 0,17
Ta có nCO32- = nOH- – nCO2 = 0,17 – 0,15 = 0,02 mBaCO3 = 0,02.197 = 3,94g

Đáp án : B
nCO2 = 0,15 mol ; nOH = 0,17 mol
=> nCO3 = nOH - nCO2 = 0,02 mol < nBa = 0,06 mol
=> nBaCO3 = 0,02 mol => m = 3,94g

Đáp án B
Ta có: nNaOH = 0,15 mol; nBa(OH)2 = 0,05 mol
Dung dịch Y chứa 0,15 mol Na+, 0,05 mol Ba2+, u mol AlO2- và v mol OH- dư
Định luật bảo toàn điện tích ta có u + v = 0,15 + 0,05.2 = 0,25 (1)
Ta có: nHCl = 0,32 mol và nH2SO4 = 0,04 mol→ nH+ = 0,4 mol; nSO4(2-) = 0,04 mol
→ nBaSO4 = 0,04 mol
Ta có: mkết tủa = 21,02 gam → nAl(OH)3 = 0,15 mol
Nếu Al(OH)3 chưa bị hòa tan thì nH+ = 0,4 = v + 0,15 (2)
Nếu Al(OH)3 đã bị hòa tan thì nH+ = 0,4 = v + 4u - 3.0,15 (3)
Giải hệ (1) và (2) ra vô nghiệm
Giải hệ (1) và (3) ra u = 0,2 và v = 0,05
Vậy Y gồm Na+ 0,15 mol; 0,05 mol Ba2+; 0,2 mol AlO2- và OH- dư (0,05 mol)
V lít dung dịch Z gồm 0,64V mol HCl và 0,08V mol H2SO4
→ nH+ = 0,8V mol và nSO4(2-) = 0,08 V mol
Khi Al(OH)3 max thì 0,8V = u+ v suy ra V = 0,3125
Suy ra nBaSO4 = 0,025 mol → mkết tủa = 21,425 gam
Khi BaSO4 max thì 0,08V = 0,05 suy ra V = 0,625
Suy ra nH+ = 0,8V = v + 4u-3.nAl(OH)3 → nAl(OH)3 = 7/60 mol → mkết tủa = 20,75 gam
Vậy mkết tủa max = 21,425 gam

nHCl = 0,5.1,4 = 0,7 (mol) ; nH2SO4 = 0,5.0,5 = 0,25 (mol) => nSO42- = nH2SO4 = 0,25 (mol)
∑ nH+ = nHCl + 2nH2SO4 = 0,7 + 2.0,25 = 1,2 (mol)
nNaOH = 2V (mol) ; nBa(OH)2 = 4V (mol)
∑ nOH- = nNaOH + 2nBa(OH)2 = 2V + 2.4V = 10V (mol)
Các PTHH xảy ra:
H+ + OH- → H2O (1)
Ba2+ + SO42- → BaSO4↓ (2)
Khi cho Zn vào dd C thấy có khí H2 thoát ra => có 2 trường hợp có thể xảy ra. Zn có thể bị hòa tan bởi dung dịch axit hoặc bazo
nH2 = 3,36 : 22,4 = 0,15 (mol)
TH1: dd C có chứa H+ dư => phản ứng (1) OH- phản ứng hết
Zn + 2H+ → Zn2+ + H2↑ (3)
0,3 ← 0,15 (mol)
=> nH+ (1) = ∑ nH+ - nH+ dư = 1,2 – 0,3 = 0,9 (mol)
Theo (1): ∑nOH- = nH+ (1) = 0,9 = 10V => V = 0,09 (lít)
nBa(OH)2 = 4.0,09 = 0,36 => nBa2+ = nBa(OH)2 = 0,36 (mol) > nSO42-
Từ PTHH (2) => nBaSO4 = nSO42- = 0,25 (mol) => mBaSO4 = 0,25.233 = 58,25(g)
TH2: dd C có chứa OH- dư => phản ứng (1) H+ phản ứng hết
Zn + 2OH- → ZnO22- + H2↑ (4)
0,3 ← 0,15 (mol)
=> ∑ nOH- = nOH-(1) + nOH- (4) = 1,2 + 0,3 = 1,5 (mol)
=> 10V = 1,5
=> V = 0,15 (lít)
=> nBa(OH)2 = 0,15. 4 = 0,6 (mol)
=> nBa2+ = 0,6 (mol) > nSO42- = 0,25 (mol)
=> mBaSO4 = 0,25.233 = 58,25 (g)

Đáp án C
n H C l = n C u C l 2 = 0,2. 0,1 = 0,02 (mol) => n H + = 0,02 (mol); n C u 2 + = 0,02(mol)
n H 2 = 0,448 :22,4 = 0,02 (mol)
Gọi chung kim loại Ba – Na là M hóa trị n
Kim loại sau khi phản ứng xong với axit sẽ tiếp tục phản ứng với H 2 O có trong dung dịch
PTHH:
M + 2 n H + → M n + + n H 2 ↑
0,02→ 0,01 (mol)
M + 2 n H 2 O → Mn+ + 2nOH- + n H 2 ↑
0,02← (0,02-0,01) (mol)
C u 2 + + 2OH- → C u ( O H ) 2
0,02 → 0,01 (mol)
=> m C u ( O H ) 2 ↓ = 0,01. 98 = 0,98 (g)