Hoà tan hoàn toàn 20 gam hỗn hợp A gồm MgCO3 và RCO3 (với tỉ lệ mol 1:1) bằng dung dịch HCl dư. Lượng CO2 sinh ra cho hấp thụ hoàn toàn bởi 500ml dung dịch Ba(OH)2 0,5 M thu được 39,4 gam kết tủa.Kim loại R là
A. Ba
B. Ca
C. Fe
D. Cu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

$Na_2CO_3 + BaCl_2 \to BaCO_3 + 2NaCl$
$n_{Na_2CO_3} = n_{BaCO_3} = \dfrac{39,4}{197} = 0,2(mol)$
$n_{NaOH} = 0,2.2,5 = 0,5(mol)$
$MgCO_3 + 2HCl \to MgCl_2 + CO_2 + H_2O$
$RCO_3 + 2HCl \to RCl_2 +C O_2 + H_2O$
TH1 : NaOH dư
$2NaOH + CO_2 \to Na_2CO_3 + H_2O$
$n_{CO_2} = n_{Na_2CO_3} = 0,2(mol)$
$\Rightarrow n_{MgCO_3} = n_{RCO_3} = n_{CO_2} :2 = 0,1(mol)$
Ta có :
0,1.84 + 0,1(R + 60) = 20
=> R = 56(Fe)
Vậy :
$m_{MgCO_3} = 0,1.84 = 8,4(gam)$
$m_{FeCO_3} = 0,1.116 = 11,6(gam)$
-TH2 : có muối $NaHCO_3$
2NaOH + CO2 → Na2CO3 + H2O
0,4............0,2...........0,2........................(mol)
NaOH + CO2 → NaHCO3
0,1..........0,1.....................(mol)
$n_{CO_2} = 0,2 + 0,1 = 0,3(mol)$
$n_{MgCO_3} = n_{RCO_3} = n_{CO_2} : 2 = 0,15(mol)$
Suy ra:
0,15.84 + 0,15(R + 60) = 20
=> R = -10,6 (Loại)
Giả sử: nMgCO3 = nRCO3 = x (mol)
⇒ 84x + x(MR + 60) = 20
⇔ (MR + 144)x = 20 (1)
PT: \(MgCO_3+2HCl\rightarrow MgCl_2+H_2O+CO_2\)
\(RCO_3+2HCl\rightarrow RCl_2+H_2O+CO_2\)
Theo PT: \(n_{CO_2}=n_{MgCO_3}+n_{RCO_3}=2x\left(mol\right)\)
Ta có: \(n_{NaOH}=0,2.2,5=0,5\left(mol\right)\)
\(n_{BaCO_3}=\dfrac{39,4}{197}=0,2\left(mol\right)=n_{Na_2CO_3}\)
PT: \(BaCl_2+Na_2CO_3\rightarrow BaCO_3+2NaCl\)
TH1: NaOH dư.
PT: \(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
____0,2 ________________0,2 (mol)
⇒ 2x = 0,2 ⇔ x = 0,1 (mol)
Thay vào (1), ta được MR = 56 (g/mol)
Vậy: R là Fe.
⇒ mMgCO3 = 0,1.84 = 8,4 (g)
mFeCO3 = 20 - 8,4 = 11,6 (g)
TH2: NaOH hết.
PT: \(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
____0,2____0,4________0,2 (mol)
\(CO_2+NaOH\rightarrow NaHCO_3\)
_0,1_____0,1 (mol)
⇒ nCO2 = 0,2 + 0,1 = 0,3 (mol)
⇒ 2x = 0,3 ⇔ x = 0,15 (mol)
Thay vào (1), ta được MR = -10,67 (loại)
Vậy...
Bạn tham khảo nhé!

$n_{NaOH} = 0,2.2,5 = 0,5(mol)$
$BaCl_2 + Na_2CO_3 \to BaCO_3 + 2NaCl$
$n_{Na_2CO_3} = n_{BaCO_3} = \dfrac{39,4}{197} = 0,2(mol)$
TH1 : có tạo muối axit
$CO_2 + 2NaOH \to Na_2CO_3 + H_2O$
$CO_2 + NaOH \to NaHCO_3$
Suy ra:
$n_{NaHCO_3} = n_{NaOH}- 2n_{Na_2CO_3} = 0,5 - 0,2.2 = 0,1(mol)$
$n_{CO_2} = n_{Na_2CO_3} + n_{NaHCO_3} = 0,3(mol)$
$MgCO_3 + 2HCl \to MgCl_2 + CO_2 + H_2O$
$RCO_3 + 2HCl \to RCl_2 + CO_2 + H_2O$
$n_{MgCO_3} = n_{RCO_3} = \dfrac{0,3}{2} = 0,15(mol)$
Suy ra:
$0,15.84 + 0,15.(R + 60) = 20 \Rightarrow R = -10,6 \to$ Loại
TH2 : NaOH dư
$2NaOH + CO_2 \to Na_2CO_3 + H_2O$
$n_{CO_2} = n_{Na_2CO_3} = 0,2(mol)$
$n_{MgCO_3} = n_{RCO_3} = \dfrac{0,2}{2} = 0,1(mol)$
$\Rightarrow 0,1.84 + 0,1(R + 60) = 20 \Rightarrow R = 56(Fe)$
$\%m_{MgCO_3} = \dfrac{0,1.84}{20}.100\% = 42\%$
$\%m_{RCO_3} = 100\% -42\% = 58\%$

MCO3 ===> CO2
a----------------a
kết tủa chính là : BaCO3 ==> nCO3 2- = 39,4/197 = 0,2 mol
giả sử lượng CO2 đủ để tạo ra 2 muối :
CO2 + NaOH ==> NaHCO3
c---------c----------------c
CO2 + 2NaOH ==> Na2CO3
b---------2b---------------b
ta có : nCO3 2 - = nNa2CO3 = 0,2 mol
a + 2b = nNaOH = 0,5 mol
==> a = 0,1 mol
==> nCO2 = a + b = 0,1 + 0,2 = 0,3 mol
==> nMgCO3 = nRCO3 = 0,15 mol
==> 20 = 84 x 0,15 + (M R + 60 ) x 0,15 ==> M R = giá trị lẻ ==> loại
- xét trường hợp lượng CO2 cần cho phản ứng chỉ tạo muối trung hòa : ( tạo muối CO3 2- )
2NaOH + CO2 ==> Na2CO3
0,4---------0,2<------------0,2 mol
==> nCO2 = nCO3 2- = 0,2 mol
==> nMgCO3 = nRCO3 = 0,1 mol
==> 84 x 0,1 + ( MR + 60 ) x 0,1 = 20
==> M R = 56 ==> R là Fe

Đáp án A
Gọi công thức TB của hai muối cacbonat là: M ¯ C O 3
M ¯ C O 3 → t 0 M O + C O 2 ( 1 )
Chất rắn Y ( M ¯ C O 3 ; M ¯ O )
n C O 2 ( 1 ) = 3 , 36 22 , 4 = 0 , 15 m o l
Y tác dụng với dung dịch HCl dư
M ¯ C O 3 + 2 H C l → t 0 M ¯ C l 2 + C O 2 + H 2 O ( 2 ) M ¯ O + H C l → t 0 M ¯ C l 2 + H 2 O ( 3 ) C O 2 + B a ( O H ) 2 → B a C O 3 + H 2 O ( 4 ) 2 C O 2 + B a ( O H ) 2 → B a ( H C O 3 ) 2 ( 5 ) B a ( H C O 3 ) 2 → t 0 B a C O 3 + C O 2 + H 2 O ( 6 ) n B a C O 3 ( 4 ) = 9 , 85 197 = 0 , 05 m o l n B a C O 3 ( 6 ) = 9 , 85 197 = 0 , 05 m o l
Theo PT (4,5,6): n C O 2 ( 3 ) = 0 , 15 m o l
Theo PT (1,2):
n M ¯ C O 3 = n C O 2 ( 2 ) + n C O 2 ( 1 ) = 0 , 15 + 0 , 15 = 0 , 3 m o l
Muối khan là: M ¯ C l 2
M ¯ C O 3 → M ¯ C l 2 M ¯ + 60 M ¯ + 71
0,3 mol muối cacbonat pư tạo 0,3 mol muối clorua tăng 3,3(g).
Khối lượng muối cacbonat ban đầu là: 38.15-3,3= 34,85(g)
Giá trị của m = 34,85(g)

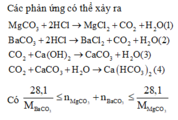
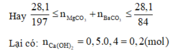
nCa(OH) =0,5.0,4 = 0,2(mol)
Nhận thấy: Lượng kết tủa thu được là lớn nhất khi chỉ xảy ra phản ứng (3) mà không có phản ứng (4) và lượng CO2 phản ứng vừa đủ với lượng Ca(OH)2 trong dung dịch.
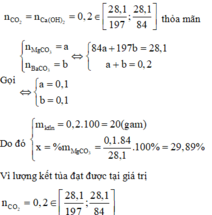
Nên hiện tượng quan sát được khi cho lượng CO2 thay đổi trong đoạn giá trị trên là: Lượng kết tủa tăng dần cho đến giá trị cực đại sau đó lượng kết tủa bị lượng CO2 dư sau phản ứng (3) hòa tan dần.
Do đó lượng kết tủa nhỏ nhất thu được ở 1 trong 2 trường hợp sau:
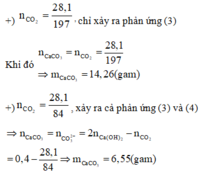
So sánh hai trường hợp ta có khối lượng kết tủa thu được nhỏ nhất là 6,55 gam khi hỗn hợp chỉ gồm MgCO3 hay x= 100.
Đáp án A
Đáp án C
Đặt nMgCO3= nRCO3= x mol → 84.x + (R+60).x= 20 gam (*)
MgCO3+ 2HCl → MgCl2+ CO2+ H2O (1)
RCO3+ 2HCl → RCl2+ CO2+ H2O (2)
Theo PT (1,2): nCO2= nMgCO3+ nRCO3= x + x= 2x mol
Ta có: nBa(OH)2= 0,5.0,5= 0,25 mol; nBaCO3= 39,4/197= 0,2 mol
Do nBa(OH)2 > nBaCO3 nên có 2 trường hợp xảy ra:
- TH1: Ba(OH)2 dư:
CO2+ Ba(OH)2 → BaCO3 + H2O
Theo PT: nCO2= nBaCO3= 0,2 mol = 2x → x= 0,1 mol
Thay x= 0,1 vào (*) ta có: R=56→ R là Fe
- TH2: Ba(OH)2 phản ứng hết
CO2 + Ba(OH)2 → BaCO3+ H2O
0,2 0,2 ← 0,2 mol
2CO2 + Ba(OH)2 → Ba(HCO3)2
0,1 ← (0,25-0,2)
Vậy nCO2= 0,2 + 0,1= 0,3 mol = 2x → x= 0,15
Thay x= 0,15 vào (*) ta có: R= -10,67 Loại
Vậy R là Fe