Khi cho quỳ tím vào dung dịch axit, quỳ tím chuyển màu gì:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


B đúng.
nHBr = 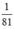 mol
mol
nNaOH = 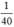 mol
mol
NaOH + HBr → NaBr + H2O
nNaOH > nHBr (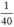 >
> 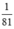 ) ⇒ sau phản ứng NaOH dư
) ⇒ sau phản ứng NaOH dư
⇒ nhúng giấy quỳ vào dung dịch thu được giấy quỳ sẽ chuyển màu xanh

Chọn D
HCl tác dụng với NaOH tạo ra muối và không làm đổi màu quỳ tím

Câu 33: Khi cho quỳ tím vào dung dịch axit, quỳ tím chuyển màu gì:
A. Đỏ B. Xanh
C. Tím D. Không màu
Câu 34: Kim loai tác dụng với nước ở nhiệt độ thường là:
A. Fe, Mg, Al B. Fe, Cu, Ag
C. Zn, Al, Ag D. Li, Na, K
Câu 35: Điện phân hoàn toàn 2 lít nước ở trạng thái lỏng (biết khối lượng riêng của nước là 1kg/l). Thể tích khí hidro và thể tích khí oxi thu được ở đktc là:
A. 1244,4 lít và 622,2 lít B. 3733,2 lít và 1866,6 lít
C. 4977,6 lít và 2488,8 lít D. 2488,8 lít và 1244,4 lít
Giải thích:
\(2H_2O\underrightarrow{đp}2H_2+O_2\)
\(\dfrac{1}{9}\) --->\(\dfrac{1}{9}\)------>\(\dfrac{1}{18}\)
\(n_{H_2O}=\dfrac{2000}{18}=\dfrac{1000}{9}\left(mol\right)\)
\(V_{H_2}=\dfrac{1000}{9}.22,4=2488,89\left(l\right)\\ V_{O_2}=\dfrac{1000}{18}.22,4=1244,44\left(l\right)\)
Câu 36: Cho mẩu Na vào nước thấy có 4,48 lít khí bay lên. Tính khối lượng Na
A.9,2 g B. 4,6g C. 2g D. 9,6g
Giải thích:
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
0,4<---------------------------0,2
\(n_{Na}=0,4.23=9,2\left(g\right)\)
Câu 37: Đốt hoàn toàn 2 mol khí H2 thì thể tích O2 cần dùng ở đktc là bao nhiêu lít?
A. 22,4 lít B. 11,2 lít C. 44,8 lít D. 8,96 lít
Giải thích:
\(2H_2+O_2\underrightarrow{t^o}2H_2O\)
2----->1
\(V_{O_2}=1.22,4=22,4\left(l\right)\)
Câu 33: A
Câu 34: D
Câu 35:
\(m_{H_2O}=2\left(kg\right)=2000\left(g\right)\Rightarrow n_{H_2O}=\dfrac{2000}{18}=\dfrac{1000}{9}\left(mol\right)\)
PT: \(2H_2O\underrightarrow{đp}2H_2+O_2\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2}=n_{H_2O}=\dfrac{1000}{9}\left(mol\right)\\n_{O_2}=\dfrac{1}{2}n_{H_2O}=\dfrac{500}{9}\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=\dfrac{1000}{9}.22,4\approx2488,8\left(l\right)\\V_{O_2}=\dfrac{500}{9}.22,4\approx1244,4\left(l\right)\end{matrix}\right.\)
→ Đáp án: D
Câu 36: A (giống câu 30)
Câu 37:
PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{H_2}=1\left(mol\right)\Rightarrow V_{O_2}=1.22,4=22,4\left(l\right)\)
→ Đáp án: A
Đáp án A