Nguyên tử Mg có ba đồng vị ứng với thành phần phần trăm về số nguyên tử như sau:

Nguyên tử khối trung bình của Mg là
A. 24
B. 24,33
C. 25
D. 25,5
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, Ta có : \(A=78,6\)%\(.24+10,1\)%.\(25+11,3\)%.\(26=24,327\)
b, \(24Mg\) 25Mg 26Mg
78,6% 10,1% 11,3%
\(x\) <--- 25 nguyên tử <-- \(y\)
Nhân chéo : \(x=\dfrac{25.78,6}{10} = 196,5 \) nguyên tử
\(y=\dfrac{25.11,3}{10} ≈28 \) nguyên tử

Đáp án C.
Ta có:
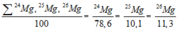
Giả sử trong hỗn hợp nói trên có 50 nguyên tử 25Mg, thì số nguyên tử tương ứng của 2 đồng vị còn lại là:
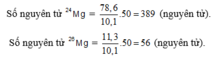

A
Giả sử trong hỗn hợp nói trên có 50 nguyên tử M 25 g , thì số nguyên tử tương ứng của 2 đồng vị còn lại là :
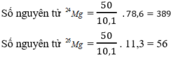

a) Đặt %24Mg là x
-->%25Mg là (100 - x - 11)
\(\overline{M}=\dfrac{x.24+\left(100-x-11\right).25+11.26}{100}=24,32\)
\(\Rightarrow x=\%^{24}Mg=79\%\)
b) ta có : \(n_{Mg}=n_{MgCl2}=1\left(mol\right)\Rightarrow n_{26_{Mg}}=1.11\%=0,11\left(mol\right)\)
Số nguyên tử : \(0,11.6,022.10^{-3}=6,6022.10^{-4}\)(nguyên tử)

Ta có:
Giả sử trong hỗn hợp nói trên có 50 nguyên tử 25Mg, thì số nguyên tử tương ứng của 2 đồng vị còn lại là:

Phần trăm đồng vị thứ nhất \(^{24}Mg\) là 78,6%.
Gọi phần trăm đồng vị \(^{25}Mg\) và \(^{26}Mg\) lần lượt là a và b.
\(\Rightarrow\left\{{}\begin{matrix}78,6\%+a\%+b\%=100\%\\24\cdot78,6\%+25\cdot a\%+26\cdot b\%=24,327\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}a=10,1\%\\b=11,3\%\end{matrix}\right.\)

Gọi x là thành phần phần trăm của H 1 thành phần phần trăm của H 1 2 sẽ là 100 –x
![]()
Giải ra ta được: x = 99,2.
Kết quả:thành phần : H 1 1 là 99,2%
H 1 2 là 0.8%
Đáp án B.
Do electron có khối lượng rất nhỏ nên nguyên tử khối trung bình của Mg xấp xỉ bằng số khối trung bình của nó: