Trong 500ml dung dịch Z có chứa 8,4 gam KOH. Tính nồng độ mol của dung dịch Z.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Vì khi pha loãng dung dịch thì số mol chất tan không đổi nên:
n KOH ban đầu = n KOH lúc sau
Gọi V là thể tích dung dịch sau khi pha loãng.
Ta có: V = n / C M = 0 , 15 / 0 , 1 = 1 , 5 ( lít ) = 1500 ( ml )
Vậy thể tích nước cần thêm vào là:
1500 – 500 = 1000 (ml).

\(a,m_{KOH}=\dfrac{28.10}{100}=2,8\left(g\right)\\ \rightarrow n_{KOH}=\dfrac{2,8}{56}=0,05\left(mol\right)\\ b,C\%=\dfrac{36}{144+36}.100\%=20\%\\ c, n_{NaOH}=\dfrac{0,8}{40}=0,02\left(mol\right)\\ \rightarrow C_{M\left(NaOH\right)}=\dfrac{0,02}{0,08}=0,25M\)
\(a,m_{KOH}=\dfrac{28.10}{100}=2,8\left(g\right)\\ n_{KOH}=\dfrac{2,8}{56}=0,05\left(mol\right)\\ C\%=\dfrac{36}{36+144}.100\%=20\%\\ C_M=\dfrac{0,8}{0,08}=10M\)

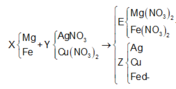
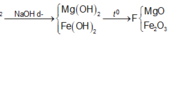
Trong F có 0,15 mol MgO và x mol Fe2O3 nên
0,1540 +x.160 = 8,4 ⇔ x = 0,015
nFe phản ứng = = 0,03
nFe dư = 0,1 – 0,03 = 0,07.
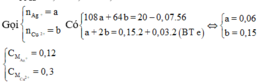
Đáp án C

nCaCO3=8,4:(40+12+16.3)=0,084 mol
nH2SO4= 0,5.1=0,5 mol
PTHH: H2SO4+ CaCO3 --> CaSO4↓ + CO2 +H2O
theo đề: 0,5 mol: 0,084 mol
=> H2SO4 de theo CaCO3
phản ứng : 0,084mol<----0,084 mol---> 0,084mol
=> CM=\(\frac{0,084}{0,5}=0,168M\)

Đáp án D
Gọi số mol HCl là x mol
HCl + KOH → KCl + H2O
x x (mol)
Giả sử KOH hết ⇒ mKCl = 74,5 . 0,1 = 7.45(g) > 6,525 ⇒KOH dư ,HCl hết.
(0,1 - x).56 + x.(39 + 35,5) = 6,525
⇒ x = 0,05 mol ⇒ CM = 0,5M

a)
\(C\%_{dd.KOH}=\dfrac{7,5}{7,5+42,5}.100\%=15\%\)
b) \(n_{HNO_3}=\dfrac{1,26}{63}=0,02\left(mol\right)\Rightarrow C_{M\left(dd.HNO_3\right)}=\dfrac{0,02}{0,016}=1,25M\)
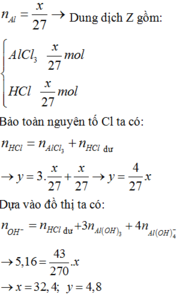
Ta có: n KOH = 8 , 4 / 56 = 0 , 15 ( mol )
→ C M ( KOH ) = 0 , 15 / 0 , 5 = 0 , 3 M .