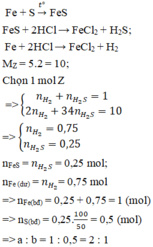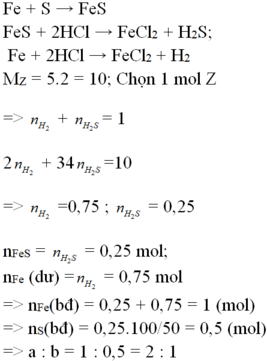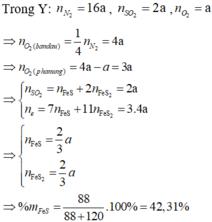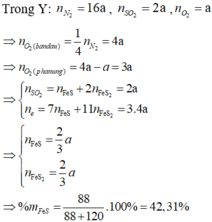đun nóng hỗn hợp gồm 5,6g fe và 6,4 g s trong điều kiện không có oxi đến khi phản ứng xảy ra hoàn toàn thu được chất rắn X tính khối lượng X . hỗn hợp X gồm so2 và o2 tỉ khối h2 bằng 28 nung hỗn hợp X một thời gian xúc tác v2o5 thu được hỗn hợp Y có tỉ khối so với X bằng 16 / 13 tính hiệu suất phản ứng tổng hợp so3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Fe}=\dfrac{16,8}{56}=0,3mol\)
\(n_S=\dfrac{6,4}{32}=0,2mol\)
\(Fe+S\rightarrow FeS\)
0,3 0,2 0,2
Sau phản ứng Fe dư và dư 0,1mol.
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\)
0,2 0,2
\(Fe_{dư}+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,1 0,1
\(\Sigma n_{khí}=0,2+0,1=0,3mol\)
\(\Rightarrow V_{khí}=0,3\cdot22,4=6,72l\)

A + H2SO4 → Hỗn hợp khí ⇒ Fe dư; khí Y gồm: H2 ( x mol) và H2S (y mol)
⇒ x + y = 0,1 mol (1)
Bảo toàn S: nH2S = nFeS = nS = y mol
nFe dư = nH2 = x
Bảo toàn Fe: nFe = nFeS + nFe dư = x + y
mX = 56(x + y ) + 32y = 7,2g (2)
Từ (1)(2) ⇒ x = 0,05 mol; y = 0,05 mol
MY = mY : nY = (0,05.2 + 0,05.34) : 0,1 = 18 ⇒ dY/H2 = 9
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{FeS}=b\left(mol\right)\end{matrix}\right.\left(đk:a,b>0\right)\)
TH1: S dư
Vậy toàn bộ lượng khí sinh ra là H2S
\(d_{Y\text{/}H_2}=d_{H_2S\text{/}H_2}=\dfrac{34}{2}=17\)
TH2: Fe dư
\(n_{khí}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Bảo toàn KL: \(m_A=m_X=7,2\left(g\right)\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a----------------------------->a
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\)
b-------------------------------->b
Ta có hệ phương trình: \(\left\{{}\begin{matrix}56a+88b=7,2\\a+b=0,1\end{matrix}\right.\)
\(\Leftrightarrow a=b=0,05\left(TM\right)\)
\(M_Y=\dfrac{0,05.\left(2+34\right)}{0,1}=18\left(g\text{/}mol\right)\\ \rightarrow d_{Y\text{/}H_2}=\dfrac{18}{2}=9\)