Cho 200ml dd NaOH 1M td vớii 200ml dd H2SO4 2M tính nồng độ các ion trong dd sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{NaOH}=0,2\left(mol\right);n_{H_2SO_4}=0,2\left(mol\right)\)
\(\Rightarrow n_{OH^-}=0,2\left(mol\right);n_{H^+}=0,4\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
0,4......0,2
Lập tỉ lệ : \(\dfrac{0,4}{1}>\dfrac{0,2}{2}\)
=> H+ dư sau phản ứng
Dung dịch X gồm các ion:
Na+ : 0,2(mol)
SO42- : 0,2 (mol)
H+ dư : 0,2mol
=> \(\left[Na^+\right]=\dfrac{0,2}{0,4}=0,5M\)
\(\left[SO_4^{2-}\right]=\dfrac{0,2}{0,4}=0,5M\)
\(\left[H^+\right]=\dfrac{0,2}{0,4}=0,5M\)
$n_{NaOH} = 0,2(mol) ; n_{H_2SO_4} = 0,2(mol)$
$2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O$
$n_{NaOH} : 2 < n_{H_2SO_4} : 1$ nên $H_2SO_4$ dư
$n_{Na_2SO_4} = n_{H_2SO_4\ pư} = \dfrac{1}{2}n_{NaOH} = 0,1(mol)$
$V_{dd} = 0,2 + 0,2 = 0,4(lít)$
$C_{M_{Na_2SO_4}} = \dfrac{0,1}{0,4} = 0,25M$
$C_{M_{H_2SO_4\ dư}} = \dfrac{0,2-0,1}{0,4} = 0,25M$
Suy ra :
$[Na^+] = 0,25.2 = 0,5M$
$[H^+] = 0,25.2 = 0,5M$
$[SO_4^{2-}] = 0,25 + 0,25 = 0,5M$

Ta có: \(n_{Na^+}=n_{OH^-}=n_{NaOH}=0,2.1=0,2\left(mol\right)\)
\(n_{SO_4^{2-}}=n_{H_2SO_4}=0,2.2=0,4\left(mol\right)\)
\(n_{H^+}=2n_{H_2SO_4}=0,8\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
0,2 ← 0,2 _________ (mol)
\(\Rightarrow n_{H^+\left(dư\right)}=0,6\left(mol\right)\)
Dung dịch thu được gồm: Na+, SO42- và H+
\(\Rightarrow\left\{{}\begin{matrix}\left[Na^+\right]=\frac{0,2}{0,4}=0,5M\\\left[SO_4^{2-}\right]=\frac{0,4}{0,4}=1M\\\left[H^+\right]=\frac{0,6}{0,4}=1,5M\end{matrix}\right.\)
Bạn tham khảo nhé!

300ml NaOH 0,1 M
=> n OH- = 0,1 * 0,3 = 0,03 mol
300ml Ba(OH)2 0,025 M
=> n OH- = 2 * 0,025 * 0,3 = 0,015 mol
vậy n OH- = 0,03 + 0,015 = 0,045 mol
200ml dd H2SO4 có nồng độ x M
=> n H+ = 2 * 0,2 * x = 0,4x mol
sau phản ứng thu được 500ml dd có pH=2
pH=2 => [H+] dư = 10^-2 = 0,01 M
=> n H+ dư = 0,01 * 0,5 = 0,005 mol
H+ + OH- ---> H2O
0,045 <---0,045
ta có: 0,4x = 0,045 + 0,005 (số mol đề bài = số mol pu + số mol dư)
=> x = 0,125 M
--------------------------------------...
n SO4 2- = 0,2x = 0,2 * 0,125 = 0,025 mol
n Ba 2+ = 0,025 * 0,3 = 0,0075 mol
Ba 2+ + SO4 2- ---> BaSO4
0,0075 --> 0,0075
m BaSO4 = 0,0075 * 233 = 1,7475 g

áp dụng quy tắc đường chéo
0,3l dd H2SO4 2M-----------------x-1 (M)
------------------------- x(M)
0,2l dd H2SO4 1M------------------2-x (M)
trong đó x là nồng độ mol của dd H2SO4 THU ĐƯỢC
=> \(\dfrac{0,3}{0,2}=\dfrac{3}{2}=\dfrac{x-1}{2-x}\)
giải PT=> x=1,6 (M)
+) Ta có: \(V_{ddH_2SO_4\left(1\right)}=300\left(ml\right)=0,3\left(l\right)\\ V_{ddH_2SO_4\left(2\right)}=200\left(ml\right)=0,2\left(l\right)\)
=> \(n_{H_2SO_4\left(1\right)}=0,3.2=0,6\left(mol\right)\\ n_{H_2SO_4\left(2\right)}=0,2.1=0,2\left(mol\right)\)
=> Nồng độ mol của dung dịch H2SO4 sau trộn:
\(C_{MddH_2SO_4\left(mới\right)}=\dfrac{0,6+0,2}{0,3+0,2}=1,6\left(M\right)\)

\(n_{NaOH}=0,02.2=0,04\left(mol\right)\\ 2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\\ a.n_{H_2SO_4}=n_{Na_2SO_4}=\dfrac{0,04}{2}=0,02\left(mol\right)\\ C_{MddH_2SO_4}=\dfrac{0,02}{0,08}=0,25\left(M\right)\\ b.\left[Na^+\right]=\dfrac{0,02.2}{0,02+0,08}=0,4\left(M\right)\\ \left[SO^{2-}_4\right]=\dfrac{0,02}{0,02+0,08}=0,2\left(M\right)\)

nCO2=0,12(mol)
nNaOH=0,2(mol)
Ta có: 1< nNaOH/nCO2=0,2/0,12=1,667<2
=> Sp thu được hỗn hợp 2 muối Na2CO3 và NaHCO3
Đặt nCO2(1), (2) lần lượt là a, b(mol) (a,b>0)
PTHH: 2 NaOH + CO2 -to-> Na2CO3 + H2O (1)
2a_________a_________a(mol)
NaOH + CO2 -> NaHCO3 (2)
b_____b______b(mol)
Từ (1), (2) ta có hpt:
\(\left\{{}\begin{matrix}2a+b=0,2\\a+b=0,12\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,08\\b=0,04\end{matrix}\right.\)
Vddsau=VddNaOH=0,2(l)
=> CMddNaHCO3= 0,04/0,2=0,2(M)
CMddNa2CO3=0,08/0,2=0,4(M)
\(n_{CO_2}=0,12mol\\ n_{NaOH}=0,2mol\\ T=\frac{n_{NaOH}}{n_{CO_2}}=\frac{0,2}{0,12}=1,66// \to Na2CO_3; NaHCO_3// 2NaOH+CO_2 \to Na_2CO_3\\ NaoH+CO_2 \to NaHCO_3\\ n_{Na_2CO_3}=a(mol)\\ n_{NaHCO_3}=b(mol)\\ n_{NaOH}=2a+b=0,2(1)\\ n_{CO_2}=a+b=0,12(2)\\ (1)(2)\\ a=0,08; b=0,04\\ CM_{Na_2CO_3}=\frac{0,08}{0,2}=0,4(mol)\\ CM_{NaHCO_3}=\frac{0,04}{0,2}=0,2(mol)\\ \)

\(a.n_{NaCl}=0,2.2=0,4\left(mol\right)\\ n_{CaCl_2}=0,5.0,2=0,1\left(mol\right)\\ \left[Na^+\right]=\left[NaCl\right]=\dfrac{0,4.1}{0,2+0,2}=1\left(M\right)\\ \left[Ca^{2+}\right]=\left[CaCl_2\right]=\dfrac{0,1.1}{0,2+0,2}=0,25\left(M\right)\\ \left[Cl^-\right]=1.1+0,25.2=1,5\left(M\right)\)
\(b.\\ n_{MgSO_4}=\dfrac{12}{120}=0,1\left(mol\right)\\ n_{Al_2\left(SO_4\right)_3}=\dfrac{34,2}{342}=0,1\left(mol\right)\\ \left[Mg^{2+}\right]=\left[MgSO_4\right]=\dfrac{0,1}{0,2+0,3}=0,2\left(M\right)\\ \left[Al^{3+}\right]=2.\left[Al_2\left(SO_4\right)_3\right]=2.\dfrac{0,1}{0,2+0,3}=0,4\left(M\right)\\ \left[SO^{2-}_4\right]=0,2.1+0,2.3=0,8\left(M\right)\)
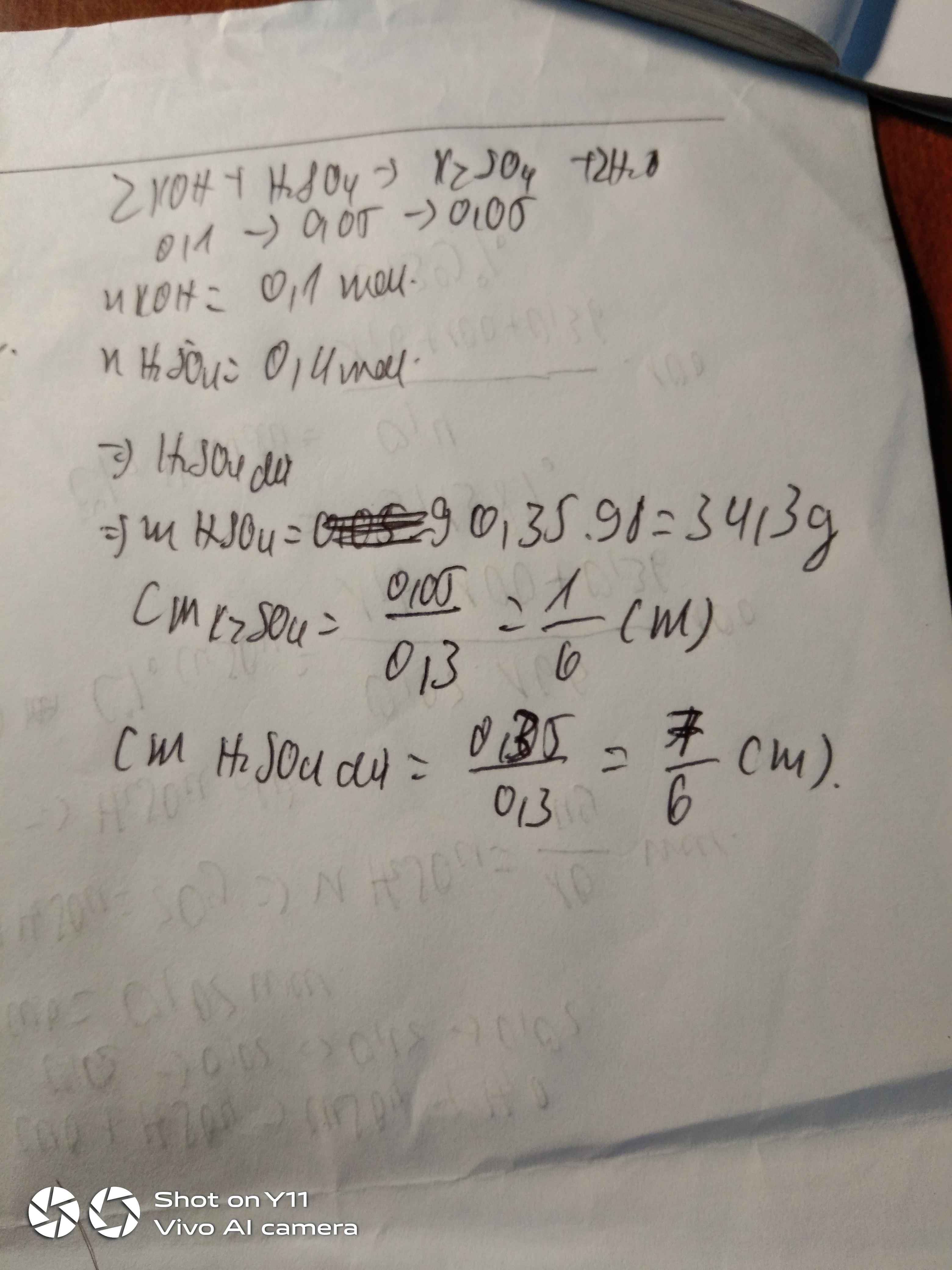
\(n_{ }_{NAOH}=0.2.1=0.2mol\)
\(n_{H_2sõ_4}=0.2.2=0.4mol\)
\(OH^-+H^+\rightarrow H_20\)
0.2 0.8
\(NAOH\rightarrow Na^++OH^-\)
0.2 0.2
\(H_2SO_4\rightarrow2H^++SO^{2-}_4\)
0.4 0.4
\(\left[Na^+\right]=\frac{0.2}{0.4}=0.5M\)
\(\left[SO^{2-}_4\right]=\frac{0.4}{0.4}=1M\)
\(\left[H^+_{dư}\right]=\frac{0,6}{0,4}=1.5M\)