Câu 5: (2,5 điểm) Cho phương trình hóa học: Zn + CuSO4→ Cu + ZnSO4.
Tính khối lượng Cu bám lên thanh kẽm, khi khối lượng dung dịch tăng 0,2 gam (Cu=64, Zn=65).
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Theo (1) có khối lượng Cu bám vào: mCu = 0,4.2,5.64 = 64 (gam)
Theo (2) có khối lượng Cu bám vào: mCu = 0,4.64 =25,6 (gam).
Đáp án A

PTHH: \(Zn+CuSO_4\rightarrow ZnSO_4+Cu\)
Giả sử \(n_{Zn\left(p/ứ\right)}=n_{Cu}=1\left(mol\right)\) và \(m_{Zn\left(ban.đầu\right)}=10\left(g\right)\)
\(\Rightarrow m_{thanh.kim.loại}=m_{Zn\left(bđ\right)}-m_{Zn\left(p/ứ\right)}+m_{Cu}=10-0,1\cdot65+0,1\cdot64=9,9\left(g\right)\)
Vậy khối lượng thanh kim loại sẽ giảm

\(n_{Zn}=\dfrac{32,25}{65}=0,49mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,49 0,49 ( mol )
\(V_{H_2}=0,49.22,4=10,976l\)
a) Ta có PTHH sau: Zn + 2HCl ---> ZnCl2 + H2
b) Ta có: nZn = 32,25/65 ∼0,5(mol)
=> nH2 = 0,5(mol)
=> V của H2 là: 0,5x22,4 = 11,2(l)
Chúc bn học tốt :)


Số mol: 0,16......0,16.............................0,16
Sau phản ứng với dung dịch CuSO4 khối lượng thanh kim loại là
![]()
Thanh kim loại sau khi lấy ra có x mol Mg dư và 0,16 mol Cu
Khi đốt trong oxi dư:
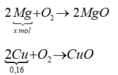
mO2 = (m + 12,8) – (m + 6,4) = 6,4 → nO2 = 0,2 mol
0,5 x + 0,08 = 0,2 → x = 0,24 mol
Khối lượng thanh kim loại sau khi lấy ra khỏi dung dịch CuSO4 là
0,24 . 24 + 0,16 . 64 = 16 gam
Đáp án C

Chọn đáp án B
n C u S O 4 p ư = 0 , 2 . 80 100 = 0 , 16 m o l
PTHH: M g + C u S O 4 → M g S O 4 + C u
Số mol: 0,16…0,16……..0,16
Sau phản ứng với dung dịch C u S o 4 khối lượng thanh kim loại là:
m 1 =m-24.0,16+64.0,16=m+6,4 (g)
Thanh kim loại sau khi lấy ra có x mol Mg dư và 0,16 mol Cu
Khi đốt trong oxi dư:
2 M g ⏟ x m o l + O 2 → 2 M g O
2 C u ⏟ 0 , 16 + O 2 → C u O
m O 2 (m + 12,8) – ( m + 6,4) = 6,4 → n O 2 =0,2 mol
0,5x + 0,08 = 0,2 x = 0,24 mol
Khối lượng thanh kim loại sau khi lấy ra khỏi dung dịch C u S O 4 là
0,24 . 24+ 0,16 . 64 = 16 gam

Số mol CuSO 4 = 10/100 = 0,1 mol
Phương trình hóa học của phản ứng:
Fe + CuSO 4 → FeSO 4 + Cu
Khối lượng Fe phản ứng: 0,1 . 56 =5,6(gam)
Khối lượng Cu sinh ra: 0,1 . 64 = 6,4 (gam)
Gọi x là khối lượng lá sắt ban đầu
Khối lượng lá sắt khi nhúng vào dung dịch CuSO 4 tăng lên là: 4x/100 = 0,04x (gam)
Khối lượng lá sắt tăng lên = m Cu sinh ra - m Fe phản ứng = 0,04x = 6,4 -5,6 = 0,8
=> x= 20 gam
Câu 5 :
$Zn + CuSO_4 \to Cu + ZnSO_4$
Ta gọi : $n_{Cu} = n_{Zn} = a(mol)$
$m_{giảm} = m_{Zn} - m_{Cu} =65a - 64a = a = 0,2(gam)$
Suy ra : $m_{Cu} = 0,2.64 = 12,8(gam)$