Hòa tan 3,38 gam oleum vào lượng nước dư thu được dd A. Để trung hòa 120 gam dd A 40 ml NaOH 0.1M. Xác định công thức oleum.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


CTPT oleum: H2SO4.nSO3 có x (mol)
H2SO4.nSO3 + nH2O → (n + 1)H2SO4
x → x(n + 1)
H2SO4 + 2NaOH → Na2SO4 + 2H2O
x(n + 1)→ 2x(n + 1)
=> (98 + 80n)x = 3,38 và 2x (n + 1) = 0,08
=> x = 0,01 và nx = 0,03
=> n = 3
Suy ra CTPT oleum: H2SO4.3SO3

số mol NaOH=0,008, suy ra số mol H2so4 trong pứ là 0,004
xét trong 200ml thì số mol h2so4 pứ vs kiềm là 0,08 mol.
PT: h2so4.nSo3+nH2O=(n+1)h2so4
0,08\(n+1)mol 0,08mol
suy ra: 0,08\(n+1) * (98+80n)=6,76
vây n=3. oleum la h2so4.3so3

Đáp án C
Đặt công thức của oleum là H2SO4.nSO3
Khi hòa tan oleum vào nước:
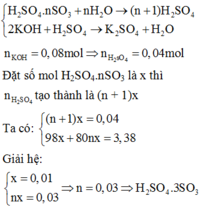

Đặt công thức của oleum là H2SO4.nSO3
Khi hòa tan oleum vào nước:

Đáp án C

H2SO4.nSO3+H2O --> (n+1)H2SO4
H2SO4+Ba(OH)2 -> BaSO4 + 2H2O
a.nBaSO4= 0,06 mol
=> nH2SO4=0,06 mol
ta có PT
\(\dfrac{4,98}{98+80n}=\dfrac{0,06}{n+1}\)
=> n=5. CT H2SO4.5SO3
b. mBaSO4= 0,06*233=13,98(g)
c)a mol H2SO4 5SO3
=> mol SO3 = 5a và H2SO4 a mol
SO3 + H2O --> H2SO4
5a--------5a----------5a
=> mol H2SO4 6a mol => mH2SO4 = 588a
=>
m dd sau hòa tan = mH2O + mA = 500 + 498a
Bảo toàn m H2SO4: 588a = 0,2(500 + 498a) => a => mA = 498a

- Ôleum hoặc acid sulfuric bốc khói đều nói về một dạng cấu thành khác của lưu huỳnh triốxit trong axít sulfuric hoặc đôi khi cụ thể hơn để acid disulfuric (còn gọi là acid pyrosulfuric).
- Oleums có thể được mô tả bởi công thức ySO3 . H2O trong đó y là tổng số mol lưu huỳnh triốxit bên trong. Giá trị của y có thể được đa dạng do đó có nhiều loại oleums khác nhau.
Chúng cũng có thể được mô tả bằng công thức H2SO4.xSO3 (bây giờ) với x là số mol lưu huỳnh triôxit tự do bên trong.
- Công thức của oleum nói chung được tính theo khối lượng của SO3 bên trong. Giá trị x = 1 cho chúng ta công thức H2S2O7 là acid (pyrosulfuric) disulfuric. Acid disulfuric tinh khiết là chất rắn ở nhiệt độ phòng, nóng chảy ở 36 ° C và ít được sử dụng trong các phòng thí nghiệm hoặc các quá trình công nghiệp.
* Gọi CT của oleum là H2SO4.xSO3 (với x > 0)
2NaOH + H2SO4 = Na2SO4 + H2O
0,008 ------> 0,004
∑ n H2SO4 = 0,004*10 = 0,04
H2SO4.xSO3 + xH2O = (x+1)H2SO4
0,04/(x+1) <--------------------0,04
=> M H2SO4.xSO3 = 3,38 / 0,04/(x+1) = 84,5 (x+1)
Do m € Z => x + 1 chia hết cho 2 => x lẻ và x > 1
cho x = 3 => CT là H2SO4.3SO3 và M = 338 (thỏa mãn)
cho x = 5 => CT là H2SO4.5SO3 < M = 507 (loại)
vậy CT của oleum là H2SO4.3SO3

\(n_{H_2SO_4.4SO_3}=\dfrac{8,36}{418}=0,02\left(mol\right)\)
PTHH: H2SO4.4SO3 + 4H2O --> 5H2SO4
0,02------------------->0,1
\(\left\{{}\begin{matrix}n_{NaOH}=0,001V.1,5=0,0015V\left(mol\right)\\n_{KOH}=0,001V.0,5=0,0005V\left(mol\right)\end{matrix}\right.\)
PTHH: 2NaOH + H2SO4 --> Na2SO4 + 2H2O
0,0015V-->0,00075V
2KOH + H2SO4 --> K2SO4 + 2H2O
0,0005V->0,00025V
=> 0,00075V + 0,00025V = 0,1
=> V = 100 (ml)
=> D

Gọi CT oleum là H2SO4.nSO3 a mol
Hòa tan vào H2O tổng nH2SO4=a+an mol
nNaOH cần=0,2 mol
SO3 + H2O =>H2SO4
an mol =>an mol
H2SO4 +2 NaOH =>Na2SO4 + 2H2O
0,1 mol<=0,2 mol
=>a+an=0,1
Mà m oleum=8,6=a(98+80n)
Giải hpt có a=1/30 và an=1/15
=>n=2
CT oleum H2SO4.2SO3

Đáp án C
Số mol NaOH là: n NaOH = 0 , 16 . 1 = 0 , 16 mol
Đặt công thức của oleum là H 2 SO 4 . nSO 3
Oleum tác dụng với H 2 O :
H 2 SO 4 . nSO 3 + nH 2 O → ( n + 1 ) H 2 SO 4 ( 1 )
Dung dịch Y là dung dịch H 2 SO 4 . Trung hòa dung dịch Y bằng dung dịch NaOH:
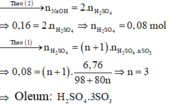
Hòa tan 3,38g oleum A vào nước , để trung hòa dung dịch A ta cần dùng 400ml NaOH 0,2M. a/ Xác định công thức oleum của A b/Cần hòa tan bao