Cho 1,03g muối natri halogen ( NaX ) tác dụng với dung dịch Agno3 dư thì thu được một kết tủa, kết tủa này sau khi phân hủy hoàn toàn cho 1,08g bạc. X là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
nAg = 0,01 (mol)
NaX + AgNO3 →AgX + NaNO3
0,01 ← 0,01 (mol)
AgX →Ag
0,01 ← 0,01 (mol)
![]() , MX =80 (Br)
, MX =80 (Br)

Chọn đáp án B
NaY + A g N O 3 → A g N O 3 + AgY
2AgY → 2Ag + Y 2
n N a Y = n A g Y = n A g = = 0,03 (mol
0,03(23+ M Y ) = 3,09 => M Y = 80 (Br)

Chọn đáp án B
NaY + A g N O 3 → N a N O 3 + AgY
2AgY → 2Ag + Y 2
n N a Y = n A g Y = n A g = = 0,01 (mol)
=> 0,01(23 + M Y ) = 1,03 => M Y = 80 (Br)

nAg = 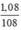 = 0,01 mol
= 0,01 mol
Phương trình hóa học của phản ứng:
Đặt X là kí hiệu, nguyên tử khối của halogen
NaX + AgNO3 → AgX↓ + NaNO3
0,01mol 0,01mol
2AgX → 2 Ag + X2
0,01mol 0,01mol
Theo pt: nNaX = nAgX = nAg = 0,1 mol
MNaX = 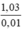 = 103 → X = 103 – 23 = 80 (Br)
= 103 → X = 103 – 23 = 80 (Br)
Muối A có công thức phân tử là NaBr

nAg=0,01 mol
NaX+AgN03------->NaN03+AgX,áp dụng bảo toàn nguyên tố Ag,nAg sau=nAg truoc
0,01--------------------------------0,01
MNaX=1,03/0,01=103------------------->X=80------->Br

nAg = 0,01 (mol)
NaX + AgNO3 →AgX + NaNO3
0,01 ← 0,01 (mol)
AgX →Ag
0,01 ← 0,01 (mol)
, MX =80 (Br)
bài 2
x mol ion Br sẽ bị thay thế bởi x mol ion Cl
1/ \(NaX+AgNO_3\rightarrow AgX+NaNO_3\)
\(2AgX\rightarrow2Ag+X_2\)
\(n_{Ag}=\frac{1,08}{108}=0,01mol\)
\(n_{Ag}=n_{AgX}=n_{NaX}=0,01mol\)
Mà \(m_{NaX}=1,03g\)
\(\rightarrow M_{NaX}=\frac{1,03}{0,01}=103\)
\(\rightarrow23+X=103\rightarrow X=80\)
Vậy X là Br

Đáp án C
Gọi công thức chung của NaX và NaY là NaM.
NaM + AgNO3 → AgM↓+NaNO3
0,03 →0,03 (mol)
![]()
=> M = 50,3 => X,Y lần lượt là Cl và Br

PTHH:
NaX+AgNO3 → AgX+NaNO3
2AgX → 2Ag+X2
Ta có:
nAg = 1,08/108 = 0,01mol
=> nAgX = 0,01mol
=> nNaX = nAgX = 0,01mol
=> MNaX = 1,03/0,01 = 103g/mol
=> MX = 103 − 23 = 80g/mol
=> X: Brom(Br)