Trong phòng thí nghiệm người ta dùng khí hiđro để khử sắt (|||) oxit thu được 11,2 gam sắt.
A) viết phương trình phản ứng xảy ra.
B) tính khối lượng sắt (|||) oxit đã tham gia phản ứng.
C) tính thể tích khí hidro đã tham gia phản ứng ở đktc
Cho H=1,O=16,fe=56

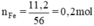


a, Fe3O4+4H2→3Fe+4H2O
b, ta có:
nFe=m/M=11,2/56=0,2 mol
theo pthh ta có:
nFe3O4=nFe=0,2 mol
⇒mFe3O4=n.M=0,2.232=46,4 gam
c,theo pthh ta có:
nH2=nFe=0,2 mol
⇒VH2=n.22,4=0,2.22,4=4,48 lít
a. Phương trình phản ứng hóa học:
Fe2O3 + 3H2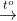 3H2O + 2Fe
3H2O + 2Fe
1mol 3mol 3mol 2mol
0,1 0,3 0,3 0,2
Số mol sắt thu được:
n =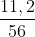 = 0,2 (mol)
= 0,2 (mol)
b. Khối lượng oxit sắt tham gia phản ứng:
m = 0,1x(56.2+16.3) = 16 (g)
c. Thể tích khí hiđro đã tiêu thụ:
V = 22,4x0,3 = 6,72 (lít).