bài tập 3: cho 22,4 gam sắt tác dụng với dung dịch loãng có chứa 24,5 gam axit sunfuric
a/ chất nào còn dư sau phản ứng và dư bao nhiêu gam?
b/ tính thể tích khí hidro thu được trong đktc?
bài tập 4: có 3 lọ đựng riêng biệt các chất khí sau: oxi không khí và hidro. bằng thí nghiệm nào có thể nhận ra chất khí trong mỗi lọ?
bài tập 5: hóa tan 0,24 gam kim loại M trong dung dịch HCL thu được 0,224 lít khí hidro ở điều kiện tiêu chuẩn. xác định tên kim loại M, biết kim loại có hóa trị từ 1 đến 3


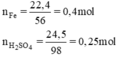

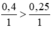 ⇒ Fe dư
⇒ Fe dư
Linh Thực ra đặt hóa trị thì cân bằng phương trình và tính theo đó cũng không khó mà?
b3
pt:2Fe+3H2SO4→→Fe2SO4+H2
a)nFe=m\M=22,4\56 =0,4(mol)
nFe2(SO4)3=m\M=24,5\340=0,07(mol)
Theo pt ta có tỉ lệ :
0,4\2>0,07\1
=>nFe dư , nFe2(SO4)3
nên ta tính theo nFe2(SO4)3
=> nFe dư = nFe đề bài - nFe phản ứng
= 2-0,2=1,8(mol)
=>mFe = n x M = 1,8 x 56 = 100,8(g)
b) Theo pt: nH2 = nFe = 1,8 (mol)
VH2 = n x 22,4 = 1,8 x 22,4 = 40,32 (l)
b4
Dùng một que đóm đang cháy cho vào mỗi lọ:
– Lọ không làm thay đổi ngọn lửa: lọ chứa không khí.
– Lọ làm que đóm cháy với ngọn lửa màu xanh mờ và có tiếng nổ lách tách nhẹ là lọ chứa hi đro (hoặc lọ còn lại chứa hiđro)
b5
2M+2HCl->2MCl+H2
2M\0,24=2\0,02
M=12
ta xét :x=1=>12 loại
..............x=2=>24 Mg
.................x=3=>36 loại
vậy kl lag Mg