pls help me
Xác định CTHH của khí A biết rằng khối lượng mol của khí A là 34. Thành phần
phần trăm theo khối lượng của khí A là 5,88%H và 94,12%S.
thank alot
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(M_A=17.2=34\left(g/mol\right)\)
\(m_H=\dfrac{5,88.34}{100}=2\left(g\right)\Rightarrow n_H=\dfrac{2}{1}=2\left(mol\right)\)
\(m_S=\dfrac{94,12.34}{100}=32\left(g\right)\Rightarrow n_S=\dfrac{32}{32}=1\left(mol\right)\)
=> CTHH: H2S
\(M_A=M_{H_2}.17=2.17=34\left(\dfrac{g}{mol}\right)\\ Đặt.CTTQ:H_xS_y\left(x,y:nguyên,dương\right)\\ \Rightarrow x:y=\dfrac{5,88\%}{1}:\dfrac{94,12\%}{32}=5,88\%:2,94\%=2:1\\ \Rightarrow x=2;y=1\\ \Rightarrow CTHH:H_2S\)

Ta có \(M_A=2.17=34(g/mol)\)
Trong 1 mol A: \(\left\{{}\begin{matrix}n_H=\dfrac{34.5,88\%}{1}=2\left(mol\right)\\n_S=\dfrac{34.94,12\%}{32}=1\left(mol\right)\end{matrix}\right.\)
Vậy CTHH A là \(H_2S\)

\(CTTQ:H_xS_y\left(x,y:nguyên,dương\right)\\ M_{H_xS_y}=17M_{H_2}=17.2=34\left(\dfrac{g}{mol}\right)\\ x=\dfrac{5,88\%.34}{1}=2;y=\dfrac{34-2.1}{32}=1\\ \Rightarrow CTPT:H_2S\)

\(M_A=17\cdot2=34\left(\dfrac{g}{mol}\right)\)
\(CT:H_xS_y\)
\(\%H=\dfrac{x}{34}\cdot100\%=5.88\%\)
\(\Rightarrow x=2\)
\(\%S=\dfrac{32y}{34}\cdot100\%=94.12\%\)
\(\Rightarrow y=1\)
\(CTHH:H_2S\)
\(M_A=17.M_{H_2}=34\left(đvC\right)\\ GọiCTcủakhíAlàH_xS\\ Tacó:\%H=\dfrac{x}{34}.100=5,88\%\\ \Rightarrow x=2\\ VậyCTHHcủaA:H_2S\)

Gọi CTHH của A là: HxSy
Vì khí A nặng hơn Khí hiđrô 17 lần nên PTK của khí A là: 2 . 17 = 34 (đvC)
x:y = \(\frac{\%H}{M_H}=\frac{\%S}{M_S}=\frac{5,88\%}{1}=\frac{94,12\%}{32}=2:1\)
=> CTHH là: ( H2S)n = 34
<=> 34n = 34 => n= 1
CTHH của A là H2S
Bài 1 :
Ta có: = 17 => MA = 17 . 2 = 34
Khối lượng của mỗi nguyên tố có trong 1 mol khí A
=> mH = = 2 (g) => mS =
= 32 (g)
hoặc mS = 34 - 2 = 32 (g)
Số mol nguyên tử của mỗi nguyên tố trong 1 mol khí A:
nH = = 2 mol nS =
= 1 mol
Suy ra trong 1 phân tử hợp chất A có 2 nguyên tử H và 1 nguyên tử S. Do đó công thức hóa học của khí A là H2S

2)M khí A= 17*2=34
cong thức tổng quát: HxSy
có:
M của H/ M khí A= % H
<=>H*x/M=5,88%
<=>1*x/34=5,88%
suy ra: x=2
=> y =1
công thức đúng là: H2S
1) Theo như SGK thì có 2,8g Fe, bạn ghi thiếu đề
a) nFe = 2,8 / 56 = 0,05 mol Phương trình hoá học: Fe + 2HCl -----> FeCl2 + H2 0, 05 mol 2.0,05 mol 0,05 mol Theo phương trình trên ta có nFe = nH = 0,05 VH2= 0,05 x 22,4 = 1,12 l. b) nHCl = 2nFe = 2 x 0,05 = 0,1 mol mHCl cần dùng: 0,1 x 36,5 = 3,65 g.

Khối lượng mol của khí A : dA/H2 = 17 ⇒ MA = 17.2 = 34 (g)
Khối lượng mỗi nguyên tố có trong 1 mol khí A:
 mS = 34 – 2 = 32 (g)
mS = 34 – 2 = 32 (g)
Số mol nguyên tử mỗi nguyên tố trong 1 mol khí A có:
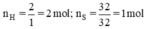
Vậy trong 1 mol phân tử chất A có : 2 nguyên tử H và 1 nguyên tử S
⇒ CTHH của khí A là H2S

Câu 1:
a) Al2O3:
Phần trăm Al trong Al2O3: \(\%Al=\dfrac{27.2}{27.2+16.3}.100=52,94\%\)
Phần trăm O trong Al2O3: \(\%O=100-52,94=47,06\%\)
b) C6H12O:
Phần trăm C trong C6H12O: \(\%C=\dfrac{12.6}{12.6+12+16}.100=72\%\)
Phần trăm H trong C6H12O: \(\%H=\dfrac{1.12}{12.6+12+16}.100=12\%\)
Phần trăm O trong C6H12O : \(\%O=100-72-12=16\%\)
Câu 2:
\(m_H=\dfrac{5,88.34}{100}\approx2\left(g\right)\)
\(m_S=\dfrac{94,12.34}{100}=32\left(g\right)\)
\(n_H=\dfrac{m}{M}=\dfrac{2}{1}=2\left(mol\right)\)
\(n_S=\dfrac{m}{M}=\dfrac{32}{32}=1\left(mol\right)\)
⇒ CTHH của hợp chất: H2S