Bài 1: Để khử hoàn toàn 13g kẽm trong dung dịch axit HCl thu được bao nhiêu lít khí H2 (đktc)?
Dẫn toàn bộ khí thu được qua 23,2g bột Fe3O4 sản phẩm thu được là một kim loại và nước, hãy tính khối lượng kim loại thu được?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Zn + 2 HCl -> ZnCl2 + H2
nZn=0,2(mol) -> nH2=0,2(mol)
PTHH: Fe3O4 + 4 H2 -to-> 3 Fe + 4 H2O
nFe3O4=23,2/232=0,1(mol)
Ta có: 0,1/1 > 0,2/4
=> H2 hết, Fe3O4 dư, tính theo nH2
=> nFe=3/4. 0,2=0,15(mol)
=> mFe=0,15. 56=8,4(g)

ta co pthh Zn+2HCl\(\rightarrow\)ZnCl2+H2(dknd)
theo de bai ta co nZn = \(\dfrac{13}{65}=0,2mol\)
theo pthh nH2=nZn=0,2 mol
\(\Rightarrow\)vH2= 0,2.22,4=4,488 l
ta co pthh 2 4 H2+Fe3O4\(\rightarrow\)3Fe +4 H2O(dknd)
theo cau a ta co nH2= 0,2 mol
theo de bai nFe3O4= \(\dfrac{23,2}{232}=0,1mol\)
theo pthh ta co nH2= \(\dfrac{0,2}{4}\)mol < nFe3O4= \(\dfrac{0,1}{1}mol\)
\(\Rightarrow\)nFe3O4 du tinh theo so mol cua H2
Vay khoi luong cua kim loai sat thu duoc la
mFe= (\(\dfrac{3}{4}.0,1\)).56=4,2 g
Ta có pthh 2Al +3 H2SO4 -> Al2(SO4)3 +3H2 theo đề bài ta có nAl= 2.7/27=0.1 mol , nH2SO4= 39.2/98= 0.4 mol .Theo pthh n Al=0.1/2 mol < nH2SO4= 0.4/3 mol -> nH2SO4 dư ( tính theo nAl) theo pthh nH2 = 3/2 nAl= 3/2* 0.1=0.15 mol -> vH2 = 0.15*22.4= 3.36l .Theo pthh nAl2(SO4)3=1/2* nAl=1/2*0.1= 0.05 mol -> mAl2(SO4)3= 0.05*342=17.1 g

Zn+2Hcl->ZnCl2+H2
0,2---0,4----0,2----0,2
n Zn=0,2 mol
=>VH2 =0,2.22,4=4,48l
mZncl2=0,2.136=27,2g
3H2+Fe2O3-to>2Fe+3H2O
0,2---------------------2\15
->m Fe=2\15.56=7,467g
nZn= 13/65=0,2(mol)
a) PTHH: Zn + 2 HCl -> ZnCl2 + H2
b) nH2=nZnCl2=nZn=0,2(mol)
=>V(H2,đktc)=0,2 x 22,4= 4,48(l)
c) khối lượng muối sau phản ứng chứ nhỉ?
mZnCl2=136.0,2=27,2(g)

Ta có : + H2 --> H2O
0,06-----0,06
--> m(R) = 3,48 - 0,06.16 = 2,52 gam
--> \(\frac{2,25n}{M}=\frac{1,008}{22,4}\)(n là hoá trị của R)
--> 28.n = M
--> n = 2 --> M = 56 (Fe)
nFe : nO = 0,045 : 0,06 = 3 : 4 --> oxit là :

\(a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{Zn}=n_{ZnCl_2}=n_{H_2}=0,25\left(mol\right)\\ \Rightarrow m_{Zn}=0,25.65=16,25\left(g\right)\\ m_{ZnCl_2}=0,25.136=34\left(g\right)\\ b.FeO+H_2-^{t^o}\rightarrow Fe+H_2O\\ Tacó:n_{Fe}=n_{H_2}=0,25\left(mol\right)\\ \Rightarrow m_{Fe}=0,25.56=14\left(g\right)\)

Đáp án C
nCO2 = nCaCO3 = 0,07 mol
O + CO → CO2
0,07 ← 0,07
mKL = moxit – mO
= 4,06 – 0,07.16 = 2,94 (g)
Gọi hóa trị của KL khi tác dụng với HCl là n
M → 0,5n H2
0,105/n← 0,0525 (mol)
![]()
![]()
![]()
![]()

1.\(n_{Zn}=\dfrac{13}{65}=0,2mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2 0,2 ( mol )
\(V_{H_2}=0,2.22,4=4,48l\)
2.\(n_{CuO}=\dfrac{12}{80}=0,15mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,15 < 0,2 ( mol )
0,15 0,15 ( mol )
\(m_{Cu}=0,15.64=9,6g\)

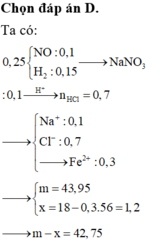
| LƯU Ý |
| + Với các bài toán liên quan tới tính oxi hóa của NO3– trong môi trường H+ thì khi có khí H2 bay ra → toàn bộ N trong NO3– phải chuyển hết vào các sản phẩm khử. + Liên qua tới Fe thì khi có khi H2 thoát ra dung dịch vẫn có thể chứa hỗn hợp muối Fe2+ và Fe3+. |
Zn+2HCl->ZnCl2+H2
0,2----------------------0,2
nZn=13\65=0,2 mol
=>VH2=0,2.22,4=4,48 l
Fe3O4+4H2-to->3Fe+4H2O
nFe3O4=23,2\232=0,1 mol
=>nFe3O4 dư
nFe=0,15 mol
=>mFe=0,15.56=8,4g
tl r mà??