Cho 1,96g bột sắt vào 100ml dd CuSO4 10% có khối lượng riêng là 1,12g/ml
a.viết PTPỨ
b.xác định nồng độ mol/lit của các chất trong dd sau khi PỨ kết thúc
c.cô cạn dd thu được bao nhiêu gam muối khan
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nMg = 0,252, nHNO3 = 1,2 & nKOH = 1,4
Vậy KOH dư, Mg2+ đã kết tủa hết, phần dung dịch chứa KNO3 & KOH dư, phần kết tủa chứa Mg(OH)2, cô cạn và nung thu được KNO2 & KOH dư & MgO
nKOH ban đầu = nKNO2 + nKOH dư = 1,4
m rắn = 85nKNO2 + 56nKOH dư + 40.0,252 = 118,06
—> nKNO2 = 1,02 & nKOH dư = 0,38
Bảo toàn N —> nN trong khí = nHNO3 – nKNO3 = 0,18
Vậy mỗi N+5 đã nhận 0,252.2/0,18 = 2,8 mol electron
—> Số oxi hóa trung bình của N = 5 – 2,8 = +2,2
—> Oxit trung bình NO1,1 (0,18 mol)
nHNO3 pư = 0,252.2 + 0,18 = 0,684
—> nHNO3 dư = 0,516
mdd = mMg + mddHNO3 – mNO1,1 = 189,36
—> C% HNO3 dư & C% Mg(NO3)2

Fe3O4 mới đúng nhé.không phải Fe2SO4
a,\(Fe_3O_4+4H_2\rightarrow3Fe+4H_2O\)
\(n_{Fe3O4}=\frac{4,64}{232}=0,02\left(mol\right)\)
\(\Rightarrow n_{Fe}=0,06\left(mol\right)\)
\(m_{Fe}=0,06.56=3,36\left(g\right)\)
b,\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(n_{H2SO4}=0,05.0,1=0,05\left(mol\right)\)
Tỉ lệ: \(\frac{0,06}{1}>\frac{0,05}{1}\)
Nên Fe dư
\(n_{Fe\left(dư\right)}=0,06-0,05=0,01\left(mol\right)\)
\(m_{Fe\left(dư\right)}=0,01.56=0,56\left(g\right)\)
\(n_{H2}=n_{H2SO4}=0,05\left(mol\right)\)
\(V_{H2}=0,05.22,4=1,12\left(l\right)\)
\(CM_{FeSO4}=\frac{0,05}{0,5}=0,1M\)
\(m_{FeSO4}=0,05.152=7,6\left(g\right)\)

a)
Fe + CuSO4 → FeSO4 + Cu
x___ x______ x________x mol
m tăng = 2,58 - 2,5 = 0,08 gam.
Ta có phương trình:
64x - 56x = 0,08
x = 0,01 mol
b)nCuSO4 ban đầu : 25.1,12.15/100.160= 0,02625 mol
mdd = + mFe(p.ư) – mCu = 25.1,12 + 0,01.56 - 0,01.64 = 27,91 g
C%, CuS04 = 0,016250.160/27,91.100% ≈ 9,32%
C%, FeSO4 =0,01.152/27,91 .100% ≈ 5,45%
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
P/ư: x x x x mol
Khối lượng lá sắt tăng = 2,58 - 2,5 = 0,08 gam. Ta có phương trình:
64x - 56x = 0,08
x = 0,01 mol
b) Sô mol CuS04 ban đầu 25.1,12.15/100.160= 0,02625 mol
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:
mdd = + mFe(p.ư) – mCu = 25.1,12 + 0,01.56 - 0,01.64 = 27,91 g
C%, CuS04 = 0,016250.160/27,91.100% ≈ 9,32%
C%, FeSO4 =0,01.152/27,91 .100% ≈ 5,45%

Đáp án B
Zn có tính khử mạnh hơn Fe, Zn sẽ phản ứng với dung dịch CuSO4 trước.
Theo đề: hỗn hợp rắn Z phản ứng với dung dịch H2SO4 loãng thu được 1 muối duy nhất → trong hỗn hợp rắn Z có Cu và Fe dư. Vậy mFe dư = 0,28 (g) và mCu = 2,84 - 0,28 = 2,56 (g)
Ta có: khối lượng hỗn hợp X phản ứng với Cu2+ = 2,7 - 0,28 = 2,42 (g)
Gọi nZn = x mol; nFe pư = y mol
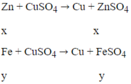
Ta có hệ:
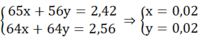
mFe ban đầu = 0,02.56 + 0,28 = 1,4 (g)
![]()
cảm ơn bn