Đốt cháy hoàn toàn 13,44 gam một muối sunfat của kim loại M hóa trị II , bằng lượng oxi vừa đủ thu được chất rắn A và khí B . Hòa tan A bằng dung dịch H2SO4 13,720% ( vừa đủ ) thu được dung dịch muối nồng độ 20,144% làm lạnh dung dịch này đến toC thấy tách ra được 12,50 gam tinh thể T , phần dung dịch bão hòa có nồng độ 14,589%
a) Xác định kim loại M và công thức của tinh thể T . Biết trong các phản ứng trên M có hóa trị không đổi
b) Tính độ tan của muối trong dung dịch bão hòa ở toC

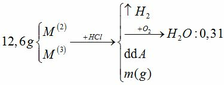
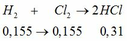
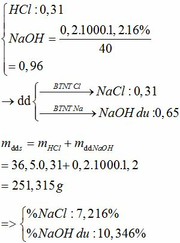



a) PTHH: 2MS + 3O2 --> 2MO + 2SO2
a a a
MO + H2SO4 --> MSO4 + H2O
a a a
Gọi a là số mol của MS
Ta có: mMSO4\mMO+mH2SO4 = a(M+96)\a(M+16)+(98a\13,72%)= 20,144%
=> M+96\(98\13,72%)+M+16 = 20,144%
Giải ra ta được: M = 64 (Cu) => a=13,44\96 = 0,14 mol
=> mddmdd sau p/ứ = mMO+mdd.H2SO4 = 98×0,14\13,72%+80×0,14 = 111,2 (g)
=> mdd sau khi làm lạnh = 111,2 - 12,5 = 98,7
PTHH: CuO + H2SO4 --> CuSO4 + H2O
Gọi b là số mol CuSO4 còn lại
Theo bài ra ta có:
C% CuSO4 = 160b\98,7× 100% = 14,589%
=> b = 0,09 mol
=> nCuSO4 đã tách ra = 0,14 - 0,09 = 0,05 mol
=> nCuSO4.xH2O=0,05 mol
=> 0,05 ( 160 + 18x ) = 12,5
=> x = 5
=> Tinh thể T là CuSO4.5H2O
b) Ta có: mH2O trong dd bão hòa = 98,7 - 0,09 x 160 = 84,3g
=> S của CuSO4 = 160×0,09×100\84,3 = 17,08g
Đặt A là MO (a mol)
\(MO+H_2SO_4\rightarrow MSO_4+H_2O\)
a_______a__________a________
\(m_{dd\left(muoi\right)}=a\left(M+16\right)+\frac{98a}{13,72\%}=a\left(M+\frac{5112}{7}\right)\)
\(C\%_{MSO4}=\frac{a\left(M+96\right)}{a\left(M+\frac{5112}{7}\right)}=20,144\%\)
\(\Rightarrow M=64\)
Vậy M là Cu
\(\Rightarrow n_{CuSO4}=n_{CuO}=n_{CuS}=a=0,14\)
\(m_{dd\left(con.lai\right)}=a\left(M+\frac{5112}{7}\right)-12,5=98,7\)
\(n_{CuSO4\left(Cl\right)}=\frac{98,7.14,589\%}{160}=0,09\)
\(\Rightarrow n_{CuSO4.kH2O}=0,14-0,09=0,05\)
\(\Rightarrow160+18k=\frac{12,5}{0,05}\)
\(\Rightarrow k=5\)
Tinh thể là CuSO4.5H2O
\(\Rightarrow C\%=\frac{S}{S+100}=14,589\%\)
\(\Rightarrow S=17\left(g\right)\)