Xác định độ tan của Na2CO3 trong nước ở 18oC. Biết rằng ở nhiệt độ này, khi hòa tan hết 143g muối ngậm nước NaCO3.10H2O trong 160g nước thì đc một dung dịch bão hòa.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ở nhiệt độ 18oC 250g nước hòa tan 53g Na2CO3 để tạo dung dịch bão hòa. Vậy ở nhiệt độ 18oC, 100g nước hòa tan Sg Na2CO3 tạo dung dịch bão hòa.
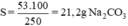
Theo định nghĩa về độ tan, ta có độ tan của Na2CO3 ở 18oC là 21,2g.

Độ tan của muối Na 2 CO 3 ở 18 º C là: S = (53 x 100)/250 = 21,2 (gam).

250 g nước hòa tan hết 53g Na2CO3
-->100g nước hòa tan x g Na2CO3
--> x= 100.53250=21,2(g)100.53250=21,2(g)
Vậy độ tan của Na2CO3 ở 18oC là 21,2(g)
Chỉnh lại cách vt đề 1 tí....
Ở nhiệt độ 18\(^o\)C 250g nước hòa tan 53g Na\(_2\)CO3 để tạo dung dịch bão hòa. Vậy ở nhiệt độ 18\(^o\)C, 100g nước hòa tan Sg Na\(_2\)CO\(_3\) tạo dung dịch bão hòa.
S= \(\frac{53.100}{250}\)= 21,2g Na\(_2\)Co\(_3\)
Theo định nghĩa về độ tan, ta có độ tan của Na\(_2\)CO\(_3\) ở 18\(^o\)C là 21,2g.
#shin

\(M_{Na2CO3.10H2O}=23.2+12+16.3+10\left(1.2+16\right)=286\left(\frac{g}{mol}\right)\)\(M_{Na2CO3}=23.2+12+16.3=106\left(\frac{g}{mol}\right)\)
Cứ 286g Na2CO3.10H2O chứa 106g Na2CO3
Cứ 143g Na2CO3.10H2O chứa x g Na2CO3
\(\Rightarrow x=143.\frac{106}{286}=53\left(g\right)\)
Ta có:
Hoà tan hết 53g Na2CO3 trong 160g nước ở 18oC thì được dd bão hoà
Hoà tan hết y g Na2CO3 trong 100g nước ở 18oC thì được dd bão hoà
Vậy độ tan của Na2CO3 trong nước ở 18oC là:
\(y=\frac{53.100}{160}=33,125\left(g\right)\)
Ta có: MNa2CO3.10H2O = 23.2+12+16.3+10.(1.2+16)=286 (g/mol)
MNa2CO3 = 23.2+12+16.3 = 106 (g/mol)
Cứ 286g Na2CO3.10H2O chứa 106g Na2CO3
=> Cứ 143g Na2CO3.10H2O chứa x g Na2CO3
=> x = \(\frac{143.106}{286}=53\left(g\right)\)
Ta có: Hoà tan hết 53g Na2CO3 trong 160g nước ở 18oC thì được dd bão hoà
=> Hoà tan hết y g Na2CO3 trong 100g nước ở 18oC thì được dd bão hoà
=> Độ tan của Na2CO3 trong nước ở 18oC là:
y = \(\frac{53.100}{160}=33,125\left(g\right)\)