Hòa tan hoàn toàn m gam SO3 trong 200 gam dung dịch h2SO4 4,9% thu được dung dịch A 9,8%
a) Xác định m
b) Hoà tan vừa đủ 5,4 g kim loại X trong 300 gam dung dịch A thu được dung dịch B xác định kim loại X
c) Cho dung dịch NaOH 10% vào dung dịch B thu được 7,8 gam kết tủa và dung dịch E tính khối lượng dung dịch NaOH cần dùng.

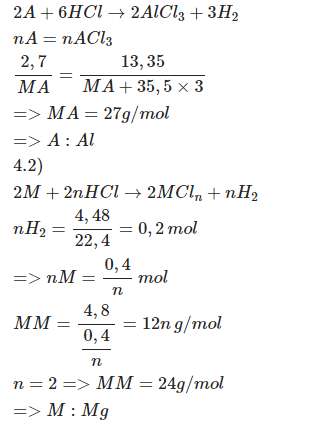
Ý a:
200 gam H2SO4 4,9% có mH2SO4 bđ = 4,9%*200 = 9,8 gam
mdd sau = mdd ban đầu + mSO2 = 200+m
H2O + SO3 -> H2SO4
=> nSO3 = nH2SO4 = \(\frac{m}{80}\)
=> mH2SO4 tạo thành = \(\frac{m}{80}\)*98= 1,225m
=> mH2SO4 sau = 9,8 + 1,225m
Ta có nồng độ dd sau = 9,8%=\(\frac{9,8+1,225m}{200+m}\cdot100\%\)
=> m = 8,7 gam
a,
\(SO_3+H_2O\rightarrow H_2SO_4\)
Gọi a là mol SO3 thêm vào
\(\Rightarrow n_{H2SO4}=a\left(mol\right)\)
\(n_{H2SO4_{ban.dau}}=\frac{300.9,8}{98}=0,3\left(mol\right)=n_{H2}\)
Gọi x là mol kim loại X hoá trị n
Bảo toàn e: \(n_x=0,3.2=0,6\)
\(x=\frac{0,6}{n}\Rightarrow M_X=\frac{5,4n}{0,6}=9n\)
\(n=3\Rightarrow M=27\left(Al\right)\)
c,
B chứa 0,1 mol Al2(SO4)3
\(Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_2+3Na_2SO_4\)
\(n_{Al\left(OH\right)3}=0,1\left(mol\right)\)
* TH1: Dư Al2(SO4)3 (dư 0,05 mol)
\(\Rightarrow n_{NaOH}=0,3\left(mol\right)\)
\(\Rightarrow m_{dd_{NaOH}}=\frac{0,3.40}{10\%}=120\left(g\right)\)
* TH2: dư kiềm (kết tủa tan 1 phần)
\(\Rightarrow n_{NaOH_{tao.kt}}=0,6\left(mol\right)\).
Có 0,2 mol Al(OH)3 tạo ra ban đầu
\(\Rightarrow\)Có 0,2-0,1= 0,1 mol Al(OH)3 tan
\(Al\left(OH\right)_2+NaOH\rightarrow\Leftarrow NaClO_2+2H_2O\)
\(\Rightarrow n_{NaOH}=0,1\left(mol\right)\)
\(\Sigma n_{NaOH}=0,6+0,1=0,7\left(mol\right)\)
\(\Rightarrow m_{dd_{NaOH}}=\frac{0,7.40}{10\%}=280\left(g\right)\)