Cho 3 gam hỗn hợp (X) gồm Mg và MgO tác dụng với axit HCl dư, thu được 672ml khí H2 (đktc).Thành phần phầm trăm của mỗi chất trong (X)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H_2}=\dfrac{0,336}{22,4}=0,015(mol)\\ PTHH:Mg+2HCl\to MgCl_2+H_2\\ MgO+2HCl\to MgCl_2+H_2O\\ \Rightarrow n_{Mg}=0,015(mol)\\ \Rightarrow \%_{Mg}=\dfrac{0,015.24}{1,5}.100\%=24\%\\ \Rightarrow \%_{MgO}=100\%-24\%=76\%\)
Chọn A

\(a.Mg+2HCl\rightarrow MgCl_2+H_2\\ MgO+2HCl\rightarrow MgCl_2+H_2O\\ b.n_{H_2}=n_{Mg}=0,1\left(mol\right)\\ \Rightarrow m_{Mg}=2,4\left(g\right)\\ \Rightarrow m_{MgO}=4,4-2,4=2\left(g\right)\\ c.\%m_{Mg}=\dfrac{2,4}{4,4}.100=54,55\%\\ \%m_{MgO}=45,45\%\\ d.\Sigma n_{HCl}=2n_{H_2}+2n_{MgO}=0,1.2+\dfrac{2}{40}.2=0,3\left(mol\right)\\ CM_{HCl}=\dfrac{0,3}{2}=0,15\left(l\right)=150ml\)

Trong 10,88 g X có x mol Cu; y mol Fe; z mol Mg
4,44 mol X có xt mol Cu; yt mol Fe; zt mol Mg
( cùng 1 loại hỗn hợp X nên tỉ lệ thành phần như nhau)
+ 10,88 g X : phản ứng với Clo tạo muối có số oxi hóa cao nhất
m muối – mKl = mCl- = 17,395g
Theo DLBT e có: 2x + 3y + 2z = nCl- = 0,49 mol (1)
mKl= 64x+ 56y + 24z = 10,88g (2)
+ 0,44mol X : tác dụng với axit HCl dư thì Fe chỉ tạo muối sắt 2
=> Theo DLBT e có: 2yt + 2zt =2nH2= 0,48 mol (3)
nX= xt+yt+zt = 0,44mol (4)
Giải hệ có: y=0,05mol => %mFe(X)=25,73%
=>B

Giả sử trong 10,88g X có x mol Cu ; y mol Fe ; z mol Mg
=> 10,88 = 64x + 56y + 24z (1)
=> 0,44 mol X có xt mol Cu ; yt mol Fe ; zt mol Mg
=> (x+y+z)t = 0,44 mol (2)
+ Xét 10,88g X + Cl2 → 28,275g rắn (Fe bị oxi hóa lên muối Fe III)
=> BTKL có m Cl2 = 17,395g
=> n Cl trong muối = n e trao đổi = 2nCl2 = 2x + 3y + 2z = 0,49 mol (3)
+Xét 0,44 mol X phản ứng với HCl thì Cu không phản ứng và Fe chỉ bị oxi hóa lên Fe II.
=> n H2 = (y + z)t = 0,24 mol (4) Từ 1;2;3;4 => y= 0,05 mol
=> %mFe(X)= 25,74% gần nhất với giá trị 25,73%
=>B

Trong 10,88 g X có x mol Cu; y mol Fe; z mol Mg
4,44 mol X có xt mol Cu; yt mol Fe; zt mol Mg
( cùng 1 loại hỗn hợp X nên tỉ lệ thành phần như nhau)
+ 10,88 g X : phản ứng với Clo tạo muối có số oxi hóa cao nhất
m muối – mKl = mCl- = 17,395g
Theo DLBT e có: 2x + 3y + 2z = nCl- = 0,49 mol (1)
mKl= 64x+ 56y + 24z = 10,88g (2)
+ 0,44mol X : tác dụng với axit HCl dư thì Fe chỉ tạo muối sắt 2
=> Theo DLBT e có: 2yt + 2zt =2nH2= 0,48 mol (3)
nX= xt+yt+zt = 0,44mol (4)
Giải hệ có: y=0,05mol => %mFe(X)=25,73%
=>B

a, PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(MgO+2HCl\rightarrow MgCl_2+H_2O\)
b, Giả sử: \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{MgO}=y\left(mol\right)\end{matrix}\right.\)
⇒ 24x + 40y = 4,4 (1)
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Mg}=x\left(mol\right)\)
⇒ x = 0,1 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,1.24}{4,4}.100\%\approx54,54\%\\\%m_{MgO}\approx45,46\%\end{matrix}\right.\)
c, Theo PT: \(\Sigma n_{HCl}=2n_{Mg}+2n_{MgO}=0,3\left(mol\right)\)
\(\Rightarrow V_{HCl}=\dfrac{0,3}{2}=0,15\left(l\right)=150\left(ml\right)\)
Bạn tham khảo nhé!

Câu 1:
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ \Rightarrow n_{Fe}=0,1\left(mol\right)\\ \Rightarrow m_{Fe}=0,1\cdot56=5,6\left(g\right)\\ \Rightarrow\%_{Fe}=\dfrac{5,6}{12}\cdot100\%\approx46,67\%\\ \Rightarrow\%_{Cu}\approx100\%-46,67\%=53,33\%\)
Bài 2:
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\\ PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ \Rightarrow n_{H_2}=n_{Zn}=0,2\left(mol\right)\\ \Rightarrow V=V_{H_2\left(đktc\right)}=0,2\cdot22,4=4,48\left(l\right)\)

nH2 \(\approx\)0,2 (mol)
Mg + 2HCl \(\rightarrow\) MgCl2 + H2 (1)
0,2 <------------ 0,2 <----- 0,2 (mol)
MgO + 2HCl \(\rightarrow\) MgCl2 + H2O (2)
b) %mMg = \(\frac{0,2.24}{8,8}\) . 100% =54,55%
%mMgO = 45,45%
c) mMgO = 8,8 - 0,2 . 24 = 4(g)
=> nMgO=0,1 (mol)
Theo pt(2) nMgCl2 = nMg = 0,1 (mol)
=> \(\Sigma n_{MgCl_2}\) = 0,2 + 0,1 = 0,3 (mol)
mmuối = 0,3 . 95 = 28,5 (g)

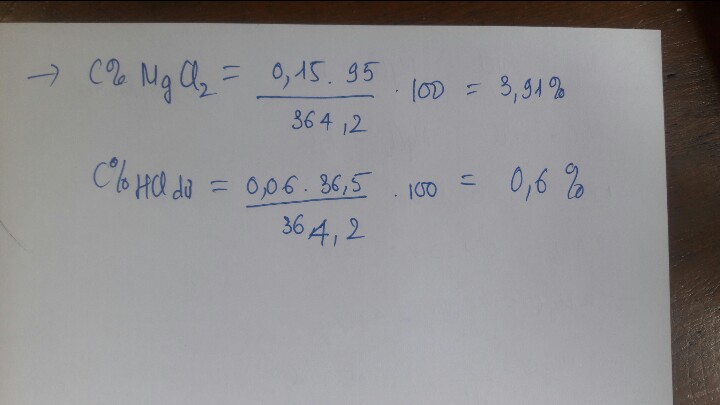
PTHH: Mg + 2HCl ---> MgCl2 + H2↑ (1)
MgO + 2HCl ---> MgCl2 + H2O (2)
Ta có: \(n_{H_2}=\dfrac{672:1000}{22,4}=0,03\left(mol\right)\)
Theo PT(1): \(n_{Mg}=n_{H_2}=0,03\left(mol\right)\)
=> \(m_{Mg}=0,03.24=0,72\left(g\right)\)
=> \(m_{MgO}=3-0,72=2,28\left(g\right)\)
=> \(\%_{m_{Mg}}=\dfrac{0,72}{3}.100\%=24\%\)
=> \(\%_{m_{MgO}}=100\%-24\%=76\%\)