Hỗn hợp khí X gồm hai kim loại K và Al có khối lượng 10,5 gam. Hòa tan hoàn toàn hỗn hợp X trong nước được dung dịch A. Thêm từ từ dung dịch HCl 1M vào dung dịch A, lúc đầu không có kết tủa, khi thêm được 100 ml dung dịch HCl 1M thì bắt đầu có kết tủa. Tính thành phần % số mol của các kim loại trong X.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có phương trình:
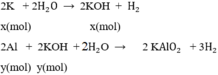
Thêm từ từ HCl vào dd A lúc đầu không có kết tủa do HCl trung hòa KOH dư:
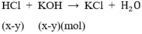
Khi HCl trung hòa hết KOH dư thì xuất hiện kết tủa:
KAlO2 + HCl + H2O → Al(OH)3 + KCl
Gọi x, y lần lượt là mol K và Al ban đầu
Để trung hòa hết KOH cần: 0,1. 1 = 0,1 mol HCl
Theo pt ⇒ x - y = 0,1
Theo bài ra ta có hệ pt:
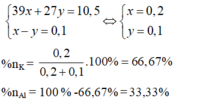

Gọi số mol K và Al trong hỗn hợp x, y
2K + 2H2O → KOH + H2 (1)
x x (mol)
2Al + 2KOH + 2H2O → 2KAlO2 + 3H2↑ (2)
y y (mol)
Do x tan hết nên Al hết, KOH dư sau (2). Khi thêm HCl, ban đầu chưa có kết tủa vì:
HCl + KOH → KCl + H2O (3)
X – y x – y (mol)
Khi HCl trung hòa hết KOH dư thì bắt đầu có kết tủa:
KAlO2 + HCl + H2O → Al(OH)3 ↓ + KCl (4)
Vậy để trung hòa KOH dư cần 100 ml dung dịch HCl 1M.
Ta có: nHCl = nKOH dư sau phản ứng (2) = x – y = 0,1.1 = 0,1 (mol) (I)
Mặt khác: 39x + 27 y = 10,5 (II)
Từ (1) và (II) => x = 0,2; y = 0,1.
% nK = 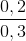 .100% = 66,67%;
.100% = 66,67%;
%nAl = 100% - 66,67% = 33,33%.
K + HOH --> KOH +1/2H2
Al + KOH + HOH --> KAlO2 +3/2H2
-Cho HCl vào bd kg có ket tua => KOH du
HCl + KOH --> KCl + HOH
-Sau đó có ket tua => KOH het => KAlO2 phan ung
KAlO2 + HCl + HOH --> Al(OH)3 + KCl
vì den 100ml dd HCl 1M co xuat hien ket tua nen => n(KAlO2) =n(HCl) = 0,1
=> n(Al) = 0,1
=> %Al = 25,71%
=> %K =74,29%
Luu y: hoi hóa xem bai giai co dung hay co van de nao kg gop ý dum nha thanks

Khi hòa tan X vào nước ta có phản ứng:
K + H2O --> KOH + (1/2)H2 ↑ (1)
Al + KOH + H2O --> KAlO2 + (3/2)H2 ↑ (2)
x ---- x
- - -
dung dịch A thu được gồm KAlO2 và KOH còn dư
khi cho HCl vào A, thì phản ứng trung hòa xãy ra trước, các pứ như sau:
HCl + KOH --> KCl + H2O (3)
HCl + KAlO2 + H2O --> KCl + Al(OH)3 ↓ (4)
3HCl + Al(OH)3 --> AlCl3 + 3H2O (5)
theo đề bài phản ứng (1) xãy ra xong, vừa bắt đầu có ↓ nên HCl vừa đủ cho pứ (3)
=> số mol HCl cho pứ (3) là 0,1*1 = 0,1 mol = mol KOH trong A
Gọi x là số mol Al => mol KOH (pư2) = x
=> mol KOH tạo thành từ (1) = x + 0,1
(ta hiểu KOH tạo ra từ (1), một phần cho pứ với Al ở (2), phần còn lại pứ với HCl)
từ (1) => mol K = x + 0,1
ta có: mX = 27x + 39(x+0,1) = 10,5 => x = 0,1
=> mAl = 27*0,1 = 2,7
%Al = 2,7*100 /10,5 = 25,71 %
% K = 74,29 %

a) Đặt nK = a và nAl = b ta có:
39a + 27b = 10,5 (1)
\(K+H_2O\rightarrow KOH+\dfrac{1}{2}H_2\)
a............................a
\(Al+KOH+H_2O\rightarrow KAlO_2+\dfrac{3}{2}H_2\)
b...........b...............................b
Thêm từ từ HCl vào dd A lúc đầu không có kết tủa do HCl trung hòa KOH dư:
\(HCl+KOH\rightarrow KCl+H_2O\)
(a-b)<-----(a-b)
Khi HCl trung hòa hết KOH dư thì xuất hiện kết tủa:
KAlO2 + HCl + H2O → Al(OH)3 + KCl
Để trung hòa hết KOH cần: 0,1. 1 = 0,1 mol HCl
a – b = nHCl = 0,1 (2)
Giải hệ (1) và (2) ta có: a = 0,2 và b = 0,1
=> \(\%m_K=\dfrac{0,2.39}{10,5}=74,29\%\); \(\%m_{Al}=25,71\%\)




Gọi số mol K và Al trong hỗn hợp x, y
2K + 2H2O → KOH + H2 (1)
x x (mol)
2Al + 2KOH + 2H2O → 2KAlO2 + 3H2↑ (2)
y y (mol)
Do x tan hết nên Al hết, KOH dư sau (2). Khi thêm HCl, ban đầu chưa có kết tủa vì:
HCl + KOH → KCl + H2O (3)
X – y x – y (mol)
Khi HCl trung hòa hết KOH dư thì bắt đầu có kết tủa:
KAlO2 + HCl + H2O → Al(OH)3 ↓ + KCl (4)
Vậy để trung hòa KOH dư cần 100 ml dung dịch HCl 1M.
Ta có: nHCl = nKOH dư sau phản ứng (2) = x – y = 0,1.1 = 0,1 (mol) (I)
Mặt khác: 39x + 27 y = 10,5 (II)
Từ (1) và (II) ⇒ x = 0,2; y = 0,1.
% nK =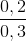 .100% = 66,67%;
.100% = 66,67%;
%nAl = 100% – 66,67% = 33,33%.