Cho 3,07 gam hỗn hợp bột kim loại X gồm Al và Fe vào 150 ml dung dịch hỗn hợp gồm Fe(NO3)3 1,0 M và AgNO3 0,5 M, khuấy đều, sau phản ứng thu được m gam kim loại và dung dịch Y (chứa ba muối). Cho từ từ dung dịch NaOH dư, lấy kết tủa nung đến khối lượng không đổi được 16,0 gam chất rắn khan. Biết các phản ứng xảy ra hoàn toàn.
a. Viết phương trình phản ứng có thể đã xảy ra.
b. Tính m và phần trăm khối lượng của Al và Fe trong X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

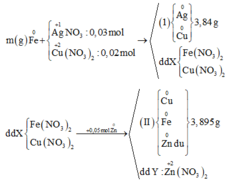
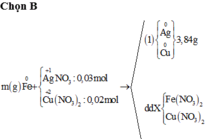
Từ sơ đồ phản ứng ta thấy Fe từ số oxi hóa 0 vẫn về 0
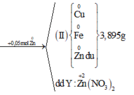
=> ne( Ag+, Cu2+ nhận) = ne ( Zn nhường)
Mà ∑ ne ( Ag+, Cu2+ nhận) = 0,03.1 + 0,02.2 = 0,07 < ne ( Zn nhường) = 0,1 (mol)
=> Zn còn dư sau phản ứng
=> nZn pư = ½ ne nhận = ½. 0,07 = 0,035 (mol)
=> nZn dư = 0,05 – 0,035 = 0,015 (mol)
mFe + mAg bđ + mCu bđ + mZn dư = mAg+Cu (I) + mCu + Fe + Zn (II)
=> mFe = mAg+Cu (I) + mCu + Fe + Zn (II) - ( mAg bđ + mCu bđ + mZn dư )
=> mFe = 3.84 + 3,895 – (0,03.108 + 0,02.64 + 0,015. 65)
mFe = 2,24 (g)
Đáp án B

Chọn đáp án B
Có 0,2.(0,15 + 0,1.2) = 0,07 mol nitrat trong suốt quá trình phản ứng, và như thế theo tiêu chí kim loại càng mạnh càng sót lại trước tiên thì dung dịch Y chỉ còn ion của kẽm khi lượng được đưa vào X lên tới 3,25/65 = 0,05 mol nên có 0,035 mol Zn2+ trong Y.
Bảo toàn khối lượng phần kim loại
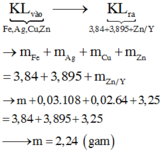

Đáp án A
![]()
↔ 0,05 mol => cuối cùng Y cho 0,035 mol Z n ( N O 3 ) 2
Bảo toàn khối lượng lần 1: ![]() = 7,26 gam
= 7,26 gam
Bảo toàn khối lượng lần 2: => m = 7,26 + 3,84 - 0,03.170 - 0,02.188 = 2,240 gam

Đáp án : D
nZn = 0,05 mol
Lại có nNO3 = 2nPb + nAg + 2nCu = 0,08 mol < 2nZn
=> Y chỉ có Zn(NO3)2 : 0,04 mol
Bảo toàn khối lượng : mZn + mmuối X = mKL(2) + mmuối Y => mMuối Y = 8,205g
Bảo toàn khối lượng với : mFe + mmuối ban đầu = mKL(1) + mmuối X
=> mFe = m = 1,575g

Chọn A.
- Hai kim loại trong Y là Ag và Cu.
- Dung dịch Z chứa 3 muối Al(NO3)3, Fe(NO3)2, Cu(NO3)2.
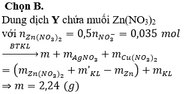


Cho 3,07 gam hỗn hợp bột kim loại X gồm Al và Fe [đã giải] – Học Hóa Online
Em có lên trang này xem rồi mà không hiểu nên mới hỏi trên h24 mà....