cho 500ml dung dịch muối natri halogenua có nồng độ 1M tác dụng hoàn toàn với dung dịch AgNO3 dư thu được 94 gam kết tủa. xác định công thức hóa học của muối đã tham gia phản ứng ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Tăng giảm khối lượng ta có; $n_{NaX}=\frac{2,35-1,5}{108-23}=0,01(mol)$
$\Rightarrow M_{NaX}=150\Rightarrow X=127$
Vậy CTHH của muối là NaI
Bảo toàn nguyên tố X và Ag ta có: $n_{AgNO_3}=n_{AgI}=0,01(mol)\Rightarrow C_{M}=1M$
PTHH: \(NaX+AgNO_3\rightarrow NaNO_3+AgX\downarrow\)
Theo PTHH: \(n_{NaX}=n_{AgX}\)
\(\Rightarrow\dfrac{1,5}{23+X}=\dfrac{2,35}{108+X}\) \(\Leftrightarrow X=127\) (Iot)
\(\Rightarrow\) Công thức: NaI
Ta có: \(n_{AgNO_3}=n_{NaI}=\dfrac{1,5}{150}=0,01\left(mol\right)\)
\(\Rightarrow C_{M_{AgNO_3}}=\dfrac{0,01}{0,01}=1\left(M\right)\)

nAg = 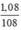 = 0,01 mol
= 0,01 mol
Phương trình hóa học của phản ứng:
Đặt X là kí hiệu, nguyên tử khối của halogen
NaX + AgNO3 → AgX↓ + NaNO3
0,01mol 0,01mol
2AgX → 2 Ag + X2
0,01mol 0,01mol
Theo pt: nNaX = nAgX = nAg = 0,1 mol
MNaX = 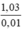 = 103 → X = 103 – 23 = 80 (Br)
= 103 → X = 103 – 23 = 80 (Br)
Muối A có công thức phân tử là NaBr

Chọn đáp án B
NaY + A g N O 3 → A g N O 3 + AgY
2AgY → 2Ag + Y 2
n N a Y = n A g Y = n A g = = 0,03 (mol
0,03(23+ M Y ) = 3,09 => M Y = 80 (Br)

Chọn đáp án B
NaY + A g N O 3 → N a N O 3 + AgY
2AgY → 2Ag + Y 2
n N a Y = n A g Y = n A g = = 0,01 (mol)
=> 0,01(23 + M Y ) = 1,03 => M Y = 80 (Br)

Gọi công thức của muối clorua là \(RCl_n\) (n là hóa trị không đổi của R)
\(RCl_n+nAgNO_3\rightarrow R\left(NO_3\right)_n+nAgCl\)
\(\dfrac{0,1}{n}\) <------------------------------------ 0,1
\(M_{RCl_n}=\dfrac{5,35}{\dfrac{0,1}{n}}=53,5n\)
\(\Leftrightarrow R+35,5n=53,5n\\ \Leftrightarrow R=18n\)
n = 1 => R = 18 (loại)
n = 2 => R = 36 (loại)
n = 3 => R = 54 (loại)
Vậy không xác định được công thức muối clorua (tức đề sai chứ hóa làm gì có vụ không xác định được: )

đặt CT của muối Clorua là \(RCl_n\left(n\inℕ^∗\right)\) là hoá trị của R
PTHH: \(RCl_n+nAgNO_3\rightarrow nAgCl\downarrow+R\left(NO_3\right)_n\)
Theo phương trình \(n_{RCl_n}.n=n_{AgCl}=0,1mol\)
\(\rightarrow\frac{5,35n}{M_R+35,5n}=0,1\)
\(\rightarrow5,35n=0,1M_R+3,55n\)
\(\rightarrow M_R=\frac{1,8}{0,1}n=18n\)
Vậy không có chất R nào thoả mãn.

nAg=0,01 mol
NaX+AgN03------->NaN03+AgX,áp dụng bảo toàn nguyên tố Ag,nAg sau=nAg truoc
0,01--------------------------------0,01
MNaX=1,03/0,01=103------------------->X=80------->Br
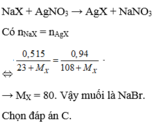

\(n_{Ag}=0,01\left(mol\right)\)
\(NaX+AgNO_3\rightarrow NaNO_3+AgX\)
0,01______________________0,01
áp dụng bảo toàn nguyên tố Ag,nAg sau=nAg truoc
\(M_{NaX}=\frac{1,03}{0,01}=103\)
\(\rightarrow X=80\left(Br\right)\)