Cho 3,04 g hỗn hợp NaOH và KOH tác dụng với dung dịch HCl, thu được 4,15 g các
muối clorua.
a) Viết các phương trình hóa học xảy ra.
b) Tính khối lượng mỗi bazo trong hỗn hợp ban đầu.
c) Tính khối lượng từng muối thu được sau phản ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a.
\(NaOH + HCl → NaCl + H_{2}O\)
x x (mol)
\(KOH + HCl → KCl + H_{2}O\)
y y (mol)
Gọi x, y lần lượt là số mol NaOH và KOH
Ta có hệ pt:
\(\begin{cases} 40x + 56y = 3.04\\ 58,5x + 74,5y = 4,15 \end{cases}\) ⇔ \(\begin{cases} x = 0,,02\\ y = 0,04 \end{cases}\)
\(m_{NaOH} = 0,02.40 = 0,8 g\)
\(m_{KOH} = 0,04.56 = 2,24 g\)
\(NaOH+HCl\rightarrow NaCl+H_2O\)
x------------------>x
\(KOH+HCl\rightarrow KCl+H_2O\)
y------------------>y
Có hệ: \(\left\{{}\begin{matrix}40x+56y=3,04\\58,5x+74,5y=4,15\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,02\\y=0,04\end{matrix}\right.\)
\(m_{NaOH}=0,02.40=0,8\left(g\right)\\ m_{KOH}=0,04.56=2,24\left(g\right)\)

Tính khối lượng của mỗi hiđroxit trong hỗn hợp ban đầu :
Đặt x và y là số mol của NaOH và KOH trong hỗn hợp, ta có hệ phương trình :
40x + 56y = 3,04
58,5x + 74,5y = 4,15
Giải hệ phương trình (I) và (II), ta được : x = 0,02 và y = 0,04.
Số gam NaOH và KOH có trong hỗn hợp là :
m NaOH = 40 x 0,02 = 0,8g
m KOH = 56 x 0,04 = 2,24g
*Có thể giải bài toán trên như sau : Đặt x (gam) là khối lượng của NaOH, khối lượng của KOH là (3,04 - x) gam.
Theo (1) : x gam NaOH sinh ra 58,5x/40 gam NaCl.
Theo (2) : (3,04 - x) gam KOH sinh ra 74,5(3,04-x)/56 gam KCl
Rút ra phương trình :
![]()
Giải phương trình, ta có : m NaOH = 0,8 gam và m KOH = 2,24 gam.

a) NaOH + HCl --> NaCl + H2O
KOH + HCl --> KCl + H2O
b) Gọi số mol của NaOH, KOH là a, b (mol)
=> 40a + 56b = 3,04
Có nNaOH = nNaCl = a (mol)
=> mNaCl = 58,5a (g)
nKOH = nKCl = b (mol)
=> mKCl = 74,5b (g)
=> 58,5a + 74,5b = 4,15
=> a = 0,02; b = 0,04
\(\left\{{}\begin{matrix}m_{NaOH}=0,02.40=0,8\left(g\right)\\m_{KOH}=0,04.56=2,24\left(g\right)\end{matrix}\right.\)
\(\left\{{}\begin{matrix}m_{NaCl}=0,02.58,5=1,17\left(g\right)\\m_{KCl}=0,04.74,5=2,98\left(g\right)\end{matrix}\right.\)
c)
PTHH: NaCl + AgNO3 --> NaNO3 + AgCl
0,02------------------------>0,02
KCl + AgNO3 --> KNO3 + AgCl
0,04--------------------->0,04
=> \(m_{AgCl}=\left(0,02+0,04\right).143,5=8,61\left(g\right)\)
\(a,NaOH+HCl\rightarrow NaCl+H_2O\\ KOH+HCl\rightarrow KCl+H_2O\\ b,Đặt:n_{NaOH}=w\left(mol\right);n_{KOH}=e\left(mol\right)\left(w,e>0\right)\\ \Rightarrow\left\{{}\begin{matrix}40w+56e=3,04\\58,5w+74,5e=4,15\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}w=0,02\left(mol\right)\\e=0,04\left(mol\right)\end{matrix}\right.\\ \Rightarrow m_{NaOH}=40w=0,8\left(g\right);m_{KOH}=56e=2,24\left(g\right)\\ c,NaCl+AgNO_3\rightarrow NaNO_3+AgCl\downarrow\\ KCl+AgNO_3\rightarrow KNO_3+AgCl\downarrow\\ n_{AgCl\downarrow}=n_{NaCl}+n_{KCl}=w+e=0,06\left(mol\right)\\ \Rightarrow m_{\downarrow}=m_{AgCl}=143,5.0,06=8,61\left(g\right)\)

\(\text{Đặt }\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\\ n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\\ a,PTHH:\left\{{}\begin{matrix}2Al+6HCl\rightarrow2AlCl_3+3H_2\\Fe+2HCl\rightarrow FeCl_2+H_2\end{matrix}\right.\\ b,\text{Theo đề ta có HPT: }\left\{{}\begin{matrix}27x+56y=8,3\\\dfrac{3}{2}x+y=0,25\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}\%_{Al}=\dfrac{0,1\cdot27}{8,3}\approx32,53\%\\\%_{Fe}\approx67,47\%\end{matrix}\right.\)
\(c,\left\{{}\begin{matrix}n_{AlCl_3}=0,1\left(mol\right)\\n_{FeCl_2}=0,1\left(mol\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}m_{AlCl_3}=0,1\cdot133,5=13,35\left(g\right)\\m_{FeCl_2}=0,1\cdot127=12,7\left(g\right)\end{matrix}\right.\\ \Rightarrow\sum m_{muối}=13,35+12,7=26,05\left(g\right)\)

\(a.2Al+6HCl->2AlCl_3+3H_2\\ Mg+2HCl->MgCl_2+H_2\\ b.n_{Al}=a,n_{Mg}=b\\ 27a+24b=7,5\left(I\right)\\ 1,5a+b=\dfrac{7,84}{22,4}=0,35\left(II\right)\\ a=0,1;b=0,2\\ \%m_{Al}=\dfrac{27\cdot0,1}{7,5}\cdot100\%=36\%\\ \%m_{Mg}=64\%\\ c.m_{HCl}=36,5\left(0,1\cdot3+0,2\cdot2\right)=18,25g\\ d.m_{ddsau}=7,5+\dfrac{18,25}{14,6:100}-0,35\cdot2=131,8g\\ C\%\left(AlCl_3\right)=\dfrac{133,5\cdot0,1}{131,8}\cdot100\%=10,1\%\\ C\%\left(MgCl_2\right)=\dfrac{95\cdot0,2}{131,8}\cdot100\%=14,4\%\)

Gọi số mol của NaOH và KOH lần lượt là x và y (mol)
PTHH:
NaOH + HCl → NaCl + H2O
x x (mol)
KOH + HCl → KCl + H2O
y y (mol)
\(\left\{{}\begin{matrix}\text{mhh=40x+56y=3,04}\\\text{mmuối=58,5x +74,5y=4,15}\end{matrix}\right.\)⇒\(\left\{{}\begin{matrix}\text{x=0,02}\\\text{y=0,04}\end{matrix}\right.\)
⇒ mNaOH = 40. 0,02= 0,8 (g)
mKOH = 56.0,04= 2,24 (g)

a) Fe + 2HCl --> FeCl2 + H2
b) \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
_____0,15<-0,3<----0,15<---0,15
\(\left\{{}\begin{matrix}\%Fe=\dfrac{0,15.56}{12}.100\%=70\%\%\\\%Cu=100\%-70\%=30\%\end{matrix}\right.\)
c) mHCl = 0,3.36,5 = 10,95 (g)
=> \(m_{dd}=\dfrac{10,95.100}{10}=109,5\left(g\right)\)
d) mdd = 12 + 109,5 - 0,15.2 = 121,2 (g)
\(C\%\left(FeCl_2\right)=\dfrac{0,15.127}{121,2}.100\%=15,718\%\)

Đáp án D.
NaOH + HCl → NaCl + H2O
x(mol) x(mol)
KOH + HCl → KCl + H2O
y(mol) y(mol)
gọi x, y lần lượt là số mol NaOH và KOH
theo bài ra ta có hệ pt
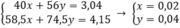
mNaOH = 0,02.40 = 0,8 (g)
mKOH = 0,04.56 = 2,24 (g)
PTHH: \(NaOH+HCl\rightarrow NaCl+H_2O\)
a_____________a (mol)
\(KOH+HCl\rightarrow KCl+H_2O\)
b_____________b
Ta lập HPT: \(\left\{{}\begin{matrix}40a+56b=3,04\\58,5a+74,5b=4,15\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,02\\b=0,04\end{matrix}\right.\)
\(\Rightarrow...\)
còn câu c