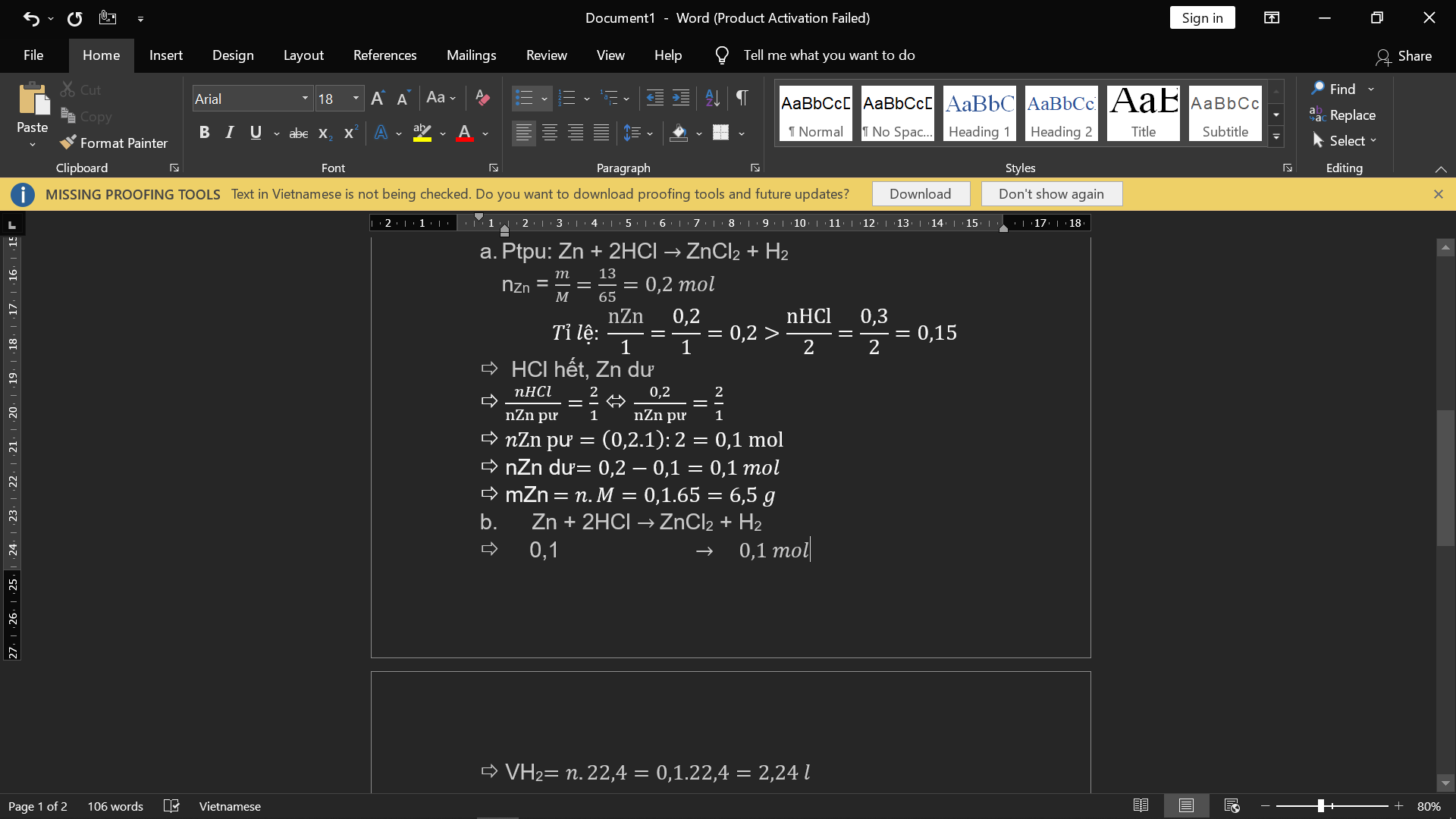
Cho 13g Zn tác dụng với 0,3 mol axit clohidric sau khi kết thúc thu được phản ứng muối kẽm clorua và khí h2
a. tính số mol mỗi chất ban đầu cho biết chất nào dư trong phản ứng?
b. tính khối lượng chất còn dư sau phản ứng?
c. tính thể tích khí hidro thu đc ở đktc?
d. tính khối lượng muối thu được sau phản ứng
giúp mình vs ạ

Zn+2HCl----->ZnCl2+H2
a) n Zn=13/65=0,2(mol)
Lập tỉ lệ
0,2>0,3/2(0,15)
----> Zn dư
b) Theo pthh
n Zn=1/2n HCl=0,15(mol)
n Zn dư=0,2-0,15=0,05(mol)
m Zn dư=0,05.65=3,25(g)
c) Theo pthh
n H2=1/2n HCl=0,15(mol)
V H2=0,15.22,4=3,36(l)
d) Theo pthh
n ZnCl2=1/2n HCl=0,15(mol)
m ZnCl2=0,15.136=20,4(g)
Chúc bạn học tốt
PTHH: Zn + 2HCl ==> ZnCl2 + H2
Ta có: nZn = 13\65=0,2(mol)
Lập tỉ lệ số mol: 0,2\1<0,3\2
=> Zn dư, HCl hết
=> Tính theo số mol HCl
Theo PTHH, nZnCl2 = 0,3\2=0,15(mol)
=> mZnCl2 = 0,15 x 136 = 20,4 (gam)
=>VH2=0,15 .22,4=3,36 l
=>mZn dư=65(0,3-0,2)= 6,5 g