Bài 2: Đổ dung dịch chứa 1g HBr vào dung dịch chứa 1g NaOH. Nhúng miếng giấy quỳ vào dung dịch thu được thì giấy quỳ sẽ đổi màu như thế nào?
Bài 3: Cho lượng dư dung dịch AgNO3 tác dụng với hỗn hợp gồm 0,1 mol NaF và 0,1 mol NaCl. Tính khối lượng kết tủa tạo thành?
Bài 4: Để trung hòa hết 200g dung dịch HX (F, Cl, Br, I) nồng độ nồng độ 14,6%. Người ta phải dùng 250 ml dung dịch NaOH 3,2M. Xác định CTHH của HX
Bài 5: Cho m gam hỗn hợp A gồm Fe và Mg vào dung dịch HCl dư thu được 5,6 lít khí (ở đktc) và dung dịch B. Cho dung dịch B tác dụng hết với dung dịch NaOH thu được 17,7 gam kết tủa.
a. Xác định khối lượng các kim loại trong hỗn hợp A.
b. Tính thể tích khí Cl2 (ở đktc) cần dùng để tác dụng hết với m gam hỗn hợp A.
Bài 6: Cho m gam hỗn hợp A gồm Fe và Mg vào dung dịch HCl dư thu được 5,6 lít khí (ở đktc) và dung dịch B. Cho dung dịch B tác dụng hết với dung dịch NaOH thu được 17,7 gam kết tủa.
a. Xác định khối lượng các kim loại trong hỗn hợp A.
b. Tính thể tích khí Cl2 (ở đktc) cần dùng để tác dụng hết với m gam hỗn hợp A.
Mn giúp em với

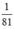 mol
mol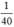 mol
mol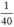 >
> 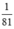 ) ⇒ sau phản ứng NaOH dư
) ⇒ sau phản ứng NaOH dư
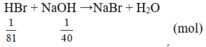
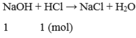
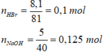
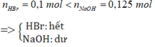
Bài 6 :
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
x ___________x _______x
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
y ____________y_______ y
\(n_{H2}=\frac{5,6}{22,4}=0,25\left(mol\right)\)
\(\rightarrow x+y=0,25\left(1\right)\)
\(2NaOH+FeCl_2\rightarrow Fe\left(OH\right)_2+2NaCl\)
__________ x ______ x
\(2NaOH+MgCl_2\rightarrow Mg\left(OH\right)_2+2NaCl\)
__________y _________ y
Ta có mFe(OH)2+mMg(OH)2=17,7
\(\rightarrow90x+58y=17,1\left(2\right)\)
(1)(2)\(\rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,15\end{matrix}\right.\)
\(\rightarrow m_{Fe}=0,1.56=5,6\left(g\right);m_{Al}=0,15.27=4,05\left(g\right)\)
\(2Fe+3Cl_2\rightarrow2FeCl_3\)
0,1____0,15
\(Mg+Cl_2\rightarrow MgCl_2\)
0,15__0,15
\(V_{Cl2}=0,3.22,4=6,72\left(l\right)\)
Bài 2 :
\(n_{HBr}=\frac{1}{81},n_{NaOH}=\frac{1}{40}\)
\(n_{NaOH}>n_{HBr}\rightarrow\) Chuyển xanh
Bài 3 :
\(m\downarrow=m_{AgCl}=0,1.143,5=14,35\left(g\right)\)
Bài 4 :
\(m_{HX}=29,2\left(g\right)\rightarrow n_{HX}=\frac{29,2}{X+1}\left(mol\right)\)
\(n_{NaOH}=0,8\left(mol\right)=n_{HX}\)
\(\rightarrow\frac{29,2}{X+1}=0,8\Leftrightarrow X=35,5\left(Cl\right)\)
Vậy HX là HCl
Bài 5 :
a, \(Fe+2HCl\rightarrow FeCl_2+H_2\)
__a____________a________a
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
b_____________b_________b
\(\rightarrow a+b=0,25\left(1\right)\)
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2\downarrow+2NaCl\)
a_________________a____________________
\(MgCl_2+2NaOH\rightarrow Mg\left(OH\right)_2+2NaCl\)
b___________________b_________________
\(m_{kettua}=17,7\left(g\right)\rightarrow90a+58b=17,7\left(2\right)\)
(1);(2) \(\rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,15\end{matrix}\right.\)
\(n_{Fe}=0,1\left(mol\right)\rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
\(n_{Mg}=0,15\left(mol\right)\rightarrow m_{Mg}=0,15.24=3,6\left(g\right)\)
b, \(2Fe+3Cl_2\underrightarrow{^{to}}2FeCl_3\)
0,1_____0,15_____________
\(Mg+Cl_2\underrightarrow{^{to}}MgCl_2\)
0,1___0,1__________
\(\rightarrow n_{Cl2}=0,15+0,1=0,25\left(mol\right)\)
\(\rightarrow V_{Cl2}=0,25.22,4=5,6\left(l\right)\)