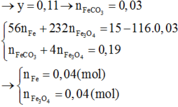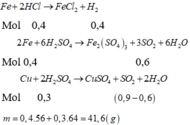1.Hỗn hợp E gồm Al,Fe3O4,FeS.Cho 46,2g E vào dd H2SO4 đặc nóng dư thu được 28 lít khi SO2 (đktc) Nếu cho 46,2 g E vào dd DCL dư thu được 11,2 lít hh khí gồm H2,H2S(đktc).Tính %m từng chất E 2.Cho m gam hh G gồm FeCO3,Al vào dd H2SO4 98% dư đun nóng thu được 10,08 lít ở đktc hh khí X gồm SO4 (sản phẩm khử duy nhất),CO2(d(X/H2)=268/9) và dd Y.Nếu cho 2m gam G và 450ml dd H2SO4 2M loãng (D=1,2 g/ml) sau phản ứng hoàn toàn thu được dd Z và V lít khí hh A (đktc).Tính %m từng chất trong G?C% từng chất trong Z và V?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ n_{SO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH:
2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
0,1<-----------------------------------0,15
Cu + 2H2SO4 ---> CuSO4 + SO2 + 2H2O
0,1<--------------------------------0,1
=> m = (56 + 64).0,1 = 12 (g)

Đáp án C
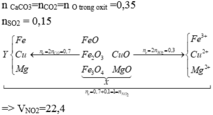
X + CO tạo thành chất rắn Y gồm các kim loại Mg, Fe, Cu và hỗn hợp khí z gồm CO2 và CO dư
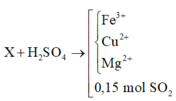
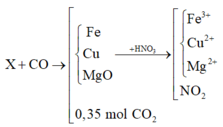
Áp dụng định luật bảo toàn mol electron
Trong thí nghiệm 1: ne nhường = ne nhận = 0,3(mol)
ne nhường trong thí nghiệm = ne nhường (1) + 2.nCO2 =1(mol) = ne nhận (2) = nNO2
Chú ý: Với các bài toán của phản ứng oxi hoá khử gồm nhiều quá trình ta thường sử dụng bảo toàn electron cho toàn bộ các quá trình, bỏ qua giai đoạn trung gian.

PTHH: \(Fe+H_2SO_{4\left(l\right)}\rightarrow FeSO_4+H_2\uparrow\)
\(2Fe+6H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
\(Cu+2H_2SO_{4\left(đ\right)}\underrightarrow{t^o}CuSO_4+SO_2\uparrow+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{Fe}=n_{H_2}=0,1\left(mol\right)\\n_{SO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,1\left(mol\right)\\n_{Cu}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{Cu}+m_{Fe}=0,1\cdot56+0,05\cdot64=8,8\left(g\right)\)
Giả sử: \(\left\{{}\begin{matrix}n_{Cu}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
_ Khi pư với H2SO4 loãng.
Theo ĐLBT mol e, có: 2y = 0,1.2 ⇒ y = 0,1 (mol) (1)
_ Khi pư với H2SO4 đặc nóng.
Ta có: \(n_{SO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo ĐLBT mol e, có: 2x + 3y = 0,2.2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,05\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
⇒ m = mCu + mFe = 0,05.64 + 0,1.56 = 8,8 (g)
Bạn tham khảo nhé!