Cho 1 lít H2 (đktc) tác dụng với 0,672 lít Cl2 (đktc) rồi hòa tan sản phẩm vào 19,27g nước được dung dịch A . Lấy 5 gam A tác dụng với dung dịch AgNO3 dư thu được 0,7175 g kết tủa. Tính hiệu suất giữa H2 và Cl2 . Biết các thể tích khí đều đo ở đktc
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{AgCl}=\dfrac{7,175}{143,5}=0,05\left(mol\right)\)
PTHH: HCl + AgNO3 ---> AgCl↓ + HNO3
0,05<---------------0,05
\(\rightarrow m_{HCl}=0,05.36,5=1,825\left(g\right)\\
\rightarrow C\%_{ddA}=\dfrac{1,825}{50}.100\%=3,65\%\)
\(n_{Cl_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Đặt H = x%
PTHH: Cl2 + H2 --as--> 2HCl
LTL: 6,72 < 10 => H2 dư
=> nHCl = 0,3x (mol)
\(\rightarrow C\%_{HCl}=\dfrac{0,3x.36,5}{0,3x.36,5+385,4}.100\%=3,65\%\\ \Leftrightarrow20,23\%\)

\(n_{H_2}=\dfrac{1}{22,4}=\dfrac{5}{112}\left(mol\right)\)
\(n_{Cl_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
PTHH: H2 + Cl2 --as--> 2HCl
Xét tỉ lệ: \(\dfrac{\dfrac{5}{112}}{1}>\dfrac{0,03}{1}\) => Hiệu suất tính theo Cl2
\(n_{AgCl}=\dfrac{7,175}{143,5}=0,05\left(mol\right)\)
Bảo toàn Cl: \(n_{Cl_2\left(pư\right)}=0,025\left(mol\right)\)
\(H\%=\dfrac{0,025}{0,03}.100\%=83,33\%\)

\(H_2+Cl_2\rightarrow2HCl\)
\(AgNO_3+HCl\rightarrow AgCl+HNO_3\)
\(n_{H2}=\frac{0,672}{22,4}=0,03\left(mol\right)\)
\(n_{CL2}=\frac{0,56}{22,4}=0,025\left(mol\right)\)
\(\rightarrow\) Tính theo Cl2
\(n_{AgCl}=\frac{1,435}{143,5}=0,01\left(mol\right)\)
\(\rightarrow n_{HCl_{bđ}}=0,02\left(mol\right)\)
\(\rightarrow n_{HCl_{lt}}=0,025.2=0,05\left(mol\right)\)
\(\rightarrow H=\frac{0,02}{0,05}.100=40\%\)

Đáp án A
P1: nFe(OH)2 = 3,6/90 = 0,04 mol => nFe2+ = 0,04 mol
P2:
Fe2+: x mol
H+: y mol
Cl-: 2x + y
3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
0,06 ← 0,08 ← 0,02
=> y = 0,08
Fe2+ + Ag+ → Fe3+ + Ag
x-0,06 → x-0,06
Ag+ + Cl- → AgCl
2x+y → 2x+y
=> 108(x-0,06) + 143,5(2x+y) = 68,2 => x = 0,16
=> nFe phản ứng ban đầu = nH2 = 0,04+0,16 = 0,2 mol => VH2 = 4,48 lít
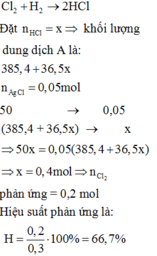



PTHH :
\(H_2+Cl_2\rightarrow2HCl\left(1\right)\)
\(HCl+AgNO_3\rightarrow AgCl+HNO_3\) \(\left(2\right)\)
Ta có : \(n_{H_2}=\frac{V}{22,4}=\frac{1}{22,4}=0,446\left(mol\right)\)
\(n_{Cl_2}=\frac{V}{22,4}=\frac{0,672}{22,4}=0,3\left(mol\right)\)
Vì \(n_{H_2}>n_{Cl_2}\Leftrightarrow n_{H_2}\) dư, \(n_{Cl_2}\) hết
Theo pt (2) : \(n_{HCl}=n_{AgCl}=0,01\left(mol\right)\) (trong 5g)
\(\Leftrightarrow n_{HCl}=0,01.4=0,04\left(mol\right)\) (trong 20g)
Theo pt (1) : \(n_{Cl_2pư}=\frac{1}{2}n_{HCl}=0,02\left(mol\right)\)
\(H=\frac{0,02}{0,03}.100\%=66,67\%\)
Vậy....
nH2=\(\frac{12}{2,4}\)=0,0446mol
nCl2=0,03mol
H2 + Cl2 → 2HCl (1)
Vì nH2>nCl2nH2>nCl2\(\rightarrow\) Hiệu suất phản ứng tính theo Cl2
AgNO3 + HCl → AgCl + HNO3
\(\rightarrow\) nHCl (trong 5g A) = nAgCl = 0,01 mol
\(\rightarrow\) nHCl (trong 20g A) = 0,01.4 = 0,04 mol
(1) => nCl2 phản ứng = 0,5.nHCl = 0,5.0,04 = 0,02 mol
=> H% = \(\frac{0,02}{0,03}.100\%\)= 66,67%