Cho 6,5g Zn vào 200 gam dung dịch FeSO4 15,2%. Sau khi phản ứng xảy ra hoàn toàn,cho biết: a/ Chất nào hết chất nào dư ? b/ Tính nồng độ % của từng chất có trong dung dịch sau phản ứng ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Vì: mA < 400 (g) nên phải có khí thoát ra → muối có dạng MHSO4 và khí là: CO2
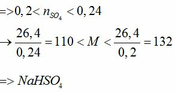
b)
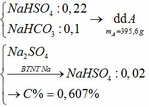
c) Tác dụng được với: MgCO3, Ba(HSO3)2, Al2O3, Fe(OH)2, Fe, Fe(NO3)2
Pt: 2NaHSO4 + MgCO3 → Na2SO4 + MgSO4 + CO2↑ + H2O
2NaHSO4 + Ba(HSO3)2 → BaSO4 + Na2SO4 + SO2↑ + 2H2O
6NaHSO4 + Al2O3 → 3Na2SO4 + Al2(SO4)3 + 3H2O
2NaHSO4 + Fe(OH)2 → Na2SO4 + FeSO4 + 2H2O
2NaHSO4 + Fe → Na2SO4 + FeSO4 + H2↑
12NaHSO4 + 9Fe(NO3)2 → 5Fe(NO3)3 + 2Fe2(SO4)3 + 6Na2SO4 + 3NO↑ + 6H2O

PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
a) Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\n_{H_2SO_4}=\dfrac{200\cdot4,9\%}{98}=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Cả 2 chất p/ứ hết
b+c) Theo PTHH: \(n_{ZnSO_4}=n_{H_2}=n_{Zn}=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{ZnSO_4}=0,1\cdot161=16,1\left(g\right)\\m_{H_2}=0,1\cdot2=0,2\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd}=m_{Zn}+m_{ddH_2SO_4}-m_{H_2}=206,3\left(g\right)\)
\(\Rightarrow C\%_{ZnSO_4}=\dfrac{16,1}{206,3}\cdot100\%\approx7,8\%\)

\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(m_{HCl}=\dfrac{200\cdot14,6\%}{100\%}=29,2g\Rightarrow n_{HCl}=0,8mol\)
a)\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,8 0 0
0,1 0,2 0,1 0,1
0 0,6 0,1 0,1
b)Chất HCl dư và dư \(m=0,6\cdot36,5=21,9g\)
c)\(V_{H_2}=0,1\cdot22,4=2,24l\)
d)\(m_{H_2}=0,1\cdot2=0,2g\)
\(m_{ZnCl_2}=0,1\cdot136=13,6g\)
\(m_{ddZnCl_2}=6,5+200-0,2=206,3g\)
\(C\%=\dfrac{13,6}{206,3}\cdot100\%=6,59\%\)
a, ta có pt sau : Zn + 2HCl >ZnCl2 + H2 (1)
b, nHCl=\(\dfrac{200\times14,6}{100}=29,2\left(g\right)\)\(\Rightarrow n_{HCl}=\dfrac{29,2}{36,5}=0,8\left(mol\right)\)
Ta có : nZn=\(\dfrac{6,5}{65}=0,1\left(mol\right)\)
Ta có tỉ lệ số mol là : \(\dfrac{n_{Zn}}{1}< \dfrac{n_{HCl}}{2}\left(\dfrac{0,1}{1}< \dfrac{0,8}{2}\right)\)
\(\Rightarrow\) HCl dư , Zn pứ hết
Theo pt : nHClpứ = 2.nZn=2.0,1=0,2(mol)
\(\Rightarrow\)nHCl dư = nHCl bđ - nHCl pứ = 0,8 - 0,2 = 0,6 (mol)
\(\Rightarrow\)mHCl dư=0,6.36,6=21,9 (g)
c,theo pt :nH2=nZn=0,1(mol)
\(\Rightarrow\)VH2=0,1.22,4=2,24(l)
d,Các chất có trong dung dịch sau pứ là: ZnCl2 , HCl dư
mk chịu câu này ![]()

nZn= 0,1 mol
nFeSO4 = 0,2 mol
PTPU : Zn + FeSO4 ---> ZnSO4 + Fe
Ban đầu: 0,1.....0,2 (Mol)
Pư : 0,1......0,1 ------>0,1..........0,1 (Mol)
Sau pư : Hết ......0,1 .........0,1 ..........0,1 (Mol)
CM ZnSO4= CM FeSO4 =0,5 M

nMg = 3,6/24 = 0,15 mol; nFeCl3 = 0,25.1 = 0,25 mol
Mg + 2FeCl3 → MgCl2 + 2FeCl2
0,125dư 0,025←0,25 → 0,125 → 0,25 (mol)
Mg + FeCl2 → MgCl2 + Fe
0,025→0,025 →0,025→0,025 (mol)
Vậy chất rắn sau phản ứng là Fe: nFe = 0,025 mol
=> m = mFe = 0,025.56 = 1,4 (gam)
Dung dịch X sau phản ứng gồm:
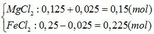
Nồng độ của các chất trong dung dịch X:
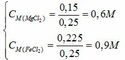



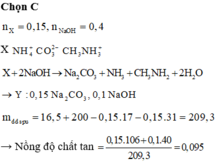
\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(m_{FeSO_4}=\dfrac{200\cdot15,2}{100}=30,4g\Rightarrow n_{FeSO_4}=0,2mol\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
0,1 0,2
\(\Rightarrow\) Zn hết, H2SO4 dư 0,1mol.
a, Có: \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
\(m_{FeSO_4}=200.15,2\%=30,4\left(g\right)\Rightarrow n_{FeSO_4}=\dfrac{30,4}{152}=0,2\left(mol\right)\)
PT: \(Zn+FeSO_4\rightarrow ZnSO_4+Fe\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,2}{1}\), ta được FeSO4 dư, Zn hết.
b, Theo PT: \(n_{ZnSO_4}=n_{Fe}=n_{FeSO_4Z\left(pư\right)}=n_{Zn}=0,1\left(mol\right)\)
\(\Rightarrow n_{FeSO_4\left(dư\right)}=0,1\left(mol\right)\)
Có: m dd sau pư = 6,5 + 200 - 0,1.56 = 200,9 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{ZnSO_4}=\dfrac{0,1.161}{200,9}.100\%\approx8,01\%\\C\%_{FeSO_4\left(dư\right)}=\dfrac{0,1.152}{200,9}.100\%\approx7,57\%\end{matrix}\right.\)
Bạn tham khảo nhé!