1. Nhiệt phân muối nitrat kim loại hóa trị 1 thu được 32,4g KL và 10,08l khí đktc . Xác định công thức phân tử của muối và tính khối lượng muối ban đầu
2. Phân hủy hoàn toàn 18,8g muối Nitrat của kim loại hóa trị x thu được 8g kim loại đó . Xác định tên kim loại
3. Cho 19,4g hỗn hợp Cu và Zn tác dụng với dung dịch HNO3 thấy thoát ra 11,44l NO2 Là sp khữ duy nhất . Tính thành phần phần trăm về khối lượng muối trong hỗn hợp ban đầu
4. Dung dịch nào sao đây có khả năng dẫn điện
A. NaCl
B. C2H5OH
C. HCHO
D. C6H12O6
6. Nguyên nhân tính dẫn điện của dung dịch các chất điện li là
A. Phân tử các chất hòa tan
B. Các ion trong dd
C. Các anion trong dung dịch
D. Các cation trong dung dịch

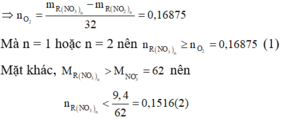
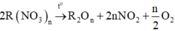

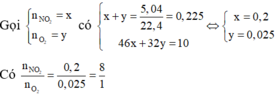
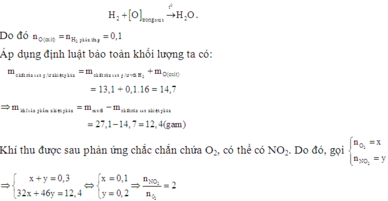

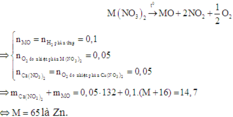

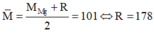
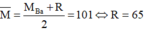
Câu 3:
nNO2 (đktc) = \(\frac{11,44}{22,4}\) = 0,51 (mol)
Đặt số mol của Cu và Zn lần lượt là x và y (mol)
→ mhh = 64x + 65y = 19,4 (I)
Qúa trình nhường e
Cu → Cu+2 + 2e
x___________ 2x (mol)
Mg → Mg+2 + 2e
y ___________2y (mol)
Quá trình nhận e
N+5 + 1e → N+4 (NO2)
_____0,52__0,52 (mol)
Bảo toàn e ta có: ne(KL nhường) = ne(N+5 nhận)
→ 2x + 2y = 0,51 (II)
Giải hệ phương trình (I) và (II) ta có x = ? và y = ?
Tuy nhiên hệ vô nghiệm nên bạn kiểm tra lại đề bài xem có vẫn đề k nhé!
Câu 4:
Dung dịch có khả năng dẫn điện là dd tan trong nước phân li ra cation và anion
Thỏa mãn: NaCl → Na+ + Cl-
B,C,D loại vì chỉ tan trong nước không phân li ra các ion
Đáp án A
1.
gọi kim loại hoá trị I là A
n khí = 10,08/22,4=0,45mol
=> công thức muối nitrat là : ANO3
pt : 2ANO3 ----đp--> 2A + 2NO2 + O2
theo pt ta có : nNO2 = 2nO2
mà nNO2 + nO2 = 0,45
⇔2nO2+nO2=0,45⇔2nO2+nO2=0,45
⇔3nO2=0,45⇔3nO2=0,45
⇔nO2=0,15mol⇔nO2=0,15mol
theo pt ta có : nM = 2nO2 = 2.0,15=0,3mol
=> MA= 32,4/0,3=108
Vậy kim loại hoá trị I là Ag
=> CT : AgNO3
theo pt ta có : nAgNO3 = 2nO2 = 2. 0,15 =0,3mol
mAgNO3 = 0,3.170 = 51g