Khi cho 9,6 gam Mg tác dụng hết với dung dịch H2SO4 đậm đặc, thấy có 49 gam H2SO4 tham gia phản ứng, tạo muối MgSO4, H2O và sản phẩm X. X là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C:
Dung dịch H2SO4đậm đặc vừa là chất oxi hóa vừa là môi trường.
Gọi a là số oxi hóa của S trong X.
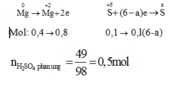
có 
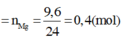
![]()
Áp dụng định luật bảo toàn mol electron, ta có:
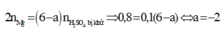
Do đó X là H2S

nMgSO4 = nMg = 0,4
nH2SO4 ban đầu = 0,5
Bảo toàn nguyên tố S ⇒ nS/khí = nH2SO4 – nMgSO4 = 0,1 mol
Cho e:
Mg0 → Mg2+ + 2e
0,4 → 0,8 (mol)
Nhận e:
S+6 + k(e) → Sx
0,02k ← 0,02 (mol)
Áp dụng định luật bảo toàn e có: 0,1k = 0,8 ⇒ k =8
k= 8 ⇒ x= -2 ⇒ Khí đó là H2S
Đáp án C.

Vì sản phẩm khử của H2SO4 đặc có nhiều dạng như SO2, S, H2S nên bài toán sử dụng cách truyền thống (viết phương trình, cân bằng và đặt ẩn) sẽ không khả thi. Vì vậy sử dụng định luật bảo toàn là cách hợp lí.
Gọi sản phẩm khử là X và k là số electron mà H2SO4 nhận để tạo ra X.
Sơ đồ phản ứng:
Al+H2SO4 đặc->Al2(SO4)3+X+H2O
![]()
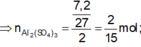
![]()
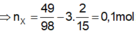


Đáp án D
Số mol các chất là:
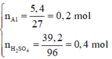
Sơ đồ phản ứng:
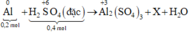
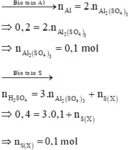
Gọi k là số electron trao đổi tạo ra S trong X
Các quá trình nhường, nhận electron:


2 Fe + 2n H2SO4 --> Fe2(SO4)n + n SO2 + n H2O
a------------an-----------0,5a
số mol Fe bằng 37,5% => a = 0,375*na => n = 2,667 khối lượng muối = 0,5a(56+96n) = 8,28 => a = 0,045 khối lượng Fe = 56*0,045 = 2,52
=> Đáp án A
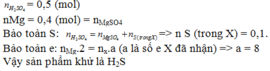
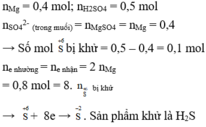


Có thể là SO2
nMg=\(\frac{9,6}{24}\)=0,4 mol
\(\text{Mg=Mg+2 +2e}\)
\(\rightarrow\) n e nhường= 0,8 mol
nH2SO4=\(\frac{49}{98}\)=0,5 mol
BTNT, nMg=nMgSO4=0,4 mol
\(\rightarrow\) 0,4 mol H2SO4 tạo muối; 0,1 mol H2SO4 là chất oxh
\(\text{S+6 +(6-x)e =S+x }\)
nS+6 (OXH)= 0,1\(\rightarrow\) n e nhận= 0,1(6-x) mol
\(\rightarrow\) Ta có pt \(\text{0,1(6-x)=0,8 }\)
\(\rightarrow\) \(\text{x=-2}\)
\(\rightarrow\) Khí X là H2S (S có số OXH -2)