Cho 5,6 lít hỗn hợp khí A gồm metan, etylen và axetilen lội qua dung dịch Brom dư thí có 52g Brom tham gia phản ứng. Đốt cháy hoàn toàn 2,6g hỗn hợp khí A thì cần vừa đủ 30,24 lít không khí. Xác định % theo V mỗi khí trong hỗn hợp A. Biết các khí đo ở đktc và trong không khí Oxi chiếm 20% về thể tích.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



a, PT: \(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
b, \(n_{Br_2}=\dfrac{5,6}{160}=0,035\left(mol\right)\)
Theo PT: \(n_{C_2H_2}=\dfrac{1}{2}n_{Br_2}=0,0175\left(mol\right)\)
\(\Rightarrow\%V_{C_2H_2}=\dfrac{0,0175.22,4}{0,86}.100\%\approx45,58\%\)
\(\Rightarrow\%V_{CH_4}\approx54,42\%\)

nBr2 = 0,125 mol
Khi đốt cháy nA = 0,25 mol
mNaOH ban đầu = 36g => nNaOH = 0,9 mol
Gọi x, y lần lượt là số mol của CO2 và H2O
mdd = 180 + 44x + 18y
Vì NaOH dư do đó chỉ tạo muối trung hòa
CO2 +2NaOH → Na2CO3 + H2O
x 2x
nNaOH dư = 0,9 – 2x
có 2 , 75 % = 40 ( 0 , 9 - 2 x ) 180 + 44 x + 18 y . 100 % (1)
=> 81,21x + 0,495y = 31,05n
2,8 lít khí A tác dụng với 0,125 mol Br2
=> 5,6 lít khí A tác dụng với 0,25 mol Br2
Gọi số mol khí của CH4, C2H4 và C2H2 lần lượt là a; b; c
Ta có a + b + c = 0,25 mol
Và b + 2c = 0,25
=> a = c
=> khi đốt cháy hỗn hợp A cho nCO2 = nH2O
Thay vào (1) => x = y = 0,38 mol
Bảo toàn C, H khi đốt cháy ta có
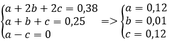
=> %VCH4 = %VC2H2 = 48%
%VC2H4 = 4%

ta có :
nBr2=\(\dfrac{16}{160}=0,1mol\)
C2H4+Br2->C2H4Br2
0,1------0,1
=>VC2H4=0,1.22,4=2,24l
=>VCH4=3,36l->n CH4=0,15 mol
->%VC2H4=\(\dfrac{2,24}{5,6}.100\)=40%
=>%VCH4=60%
c)
CH4+2O2-to>CO2+2H2O
0,15---------------0,15
C2H4+3O2--to>2CO2+2H2O
0,1--------------------0,2
=>m CaCO3=0,35.100=35g

Đáp án A
Đặt nCH4 = x mol, nC2H2 = y mol → x + y =0,25 mol
nBr2(pư) = 2y =0,1 mol → y =0,05 mol
→ x = 0,2 mol
→ VCH4 = 4,48 lít và VC2H2 =1,12 lít

a) \(n_{Br_2}=\dfrac{32}{160}=0,2\left(mol\right)\)
PTHH: C2H2 + 2Br2 --> C2H2Br4
0,1<-----0,2
=> mC2H2 = 0,1.26 =2,6 (g)
\(\%m_{C_2H_2}=\dfrac{2,6}{8}.100\%=32,5\%\)
\(\%m_{CH_4}=\dfrac{8-2,6}{8}.100\%=67,5\%\)
b) \(n_{CH_4}=\dfrac{8-2,6}{16}=0,3375\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,3375->0,675
2C2H2 + 5O2 --to--> 4CO2 + 2H2O
0,1---->0,25
=> VO2 = (0,675 + 0,25).22,4 = 20,72 (l)
=> Vkk = 20,72.5 = 103,6 (l)
refer
Gọi x, y lần lượt là số mol của C2H4, C2H2 ( x, y > 0 )
nBr2 = 0,2 mol
C2H4 + Br2 → C2H4Br2
x............x...............x
C2H2 + 2Br2 → C2H2Br4
y.............2y..............y
Ta có hệ
{28x+26y=4,1x+2y=0,2{28x+26y=4,1x+2y=0,2
⇒ {x=0,1y=0,05{x=0,1y=0,05
⇒ %C2H4 = 0,1.28.100%4,10,1.28.100%4,1≈≈68,3%
⇒ %C2H2 = 0,05.26.100%4,10,05.26.100%4,1 ≈≈ 31,7%
C2H4 + 3O2 ---to---> 2CO2 + 2H2O
0,1.........0,3
⇒ VO2 = 0,3.22,4 = 6,72 (l)
2C2H2 + 5O2 ---to---> 4CO2 + 2H2O
0,05.......0,125
⇒ VO2 = 0,125.22,4 = 2,8 (l)
⇒ ∑∑VO2 = 6,72 + 2,8 = 9,52 (l)

\(C_2H_2+2Br_2->C_2H_2Br_4\\ n_{hh}=\dfrac{3,36}{22,4}=0,15mol\\ n_{CH_4}=\dfrac{2,24}{22,4}=0,1mol\\ n_{C_2H_2}=0,05mol\\ n_{Br_2}=2.0,05=0,1mol\\ m_{Br_2}=0,1.160=16g\\ \%V_{CH_4}=\dfrac{0,1}{0,15}.100\%=66,67\%\\ \%V_{C_2H_2}=33,33\%\)

a) Khi cho metan và axetilen qua dung dịch brom thì metan không phản ứng với brom nên thoát ra khỏi bình còn axetilen phản ứng với dung dịch brom.
=> 20,16 lít khí thoát là metan CH4
=> V axetilen = 40,32 - 20,16 = 20,16 lít
<=> %V CH4 = %V C2H2 = 50%
b)
nCH4 = nC2H2 = \(\dfrac{20,16}{22,4}\)= 0,9 lít
CH4 + 2O2 → CO2 + 2H2O
C2H2 + \(\dfrac{5}{2}\)O2 → 2CO2 + H2O
Theo tỉ lệ phản ứng cháy => nO2 cần để đốt cháy hết hỗn hợp khí = 2nCH4+\(\dfrac{5}{2}\)nC2H2= 4,05 mol.
=> V O2 cần dùng = 4,05.22,4 = 90,72 lít