Cứ phân tích một chất huu cơ A thây cứ 4,2g C lại có 5,6 g oxi và 0,7 g hiđro. Xác định cônthưcs phân tử , biết 2g chât huu cơ A chiếm 746,6 cm3 ở dktc.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Phân tích chất A thấy 4,2 gam C có 5,6 gam O và 0,7 gam H.
Ta có:
\(\text{nC=4,2/12=0,35 mol;}\)
\(\text{nO=5,6.16=0,35 mol;}\)
\(\text{nH=0,7/1=0,7 mol}\)
-> Trong chất A tỉ lệ C:H:O=0,35:0,7:0,35=1:2:1.
-> A có dạng (CH2O)n
Ta có 2 gam A có thể tích là 746,6 cm3
-> nA=0,7466/22,4=0,03333333=1/30
\(\text{-> M A=2/(1/30)=60}\)
\(\text{-> (12+2+16).n=60 -> n=2 }\)
-> CTPT của A là C2H4O2

do hỗn hợp thu đc chỉ có CO2 và H2O => ct CxHy mà nCO2=O,5 mol , nH2O=0,5mol,=>đó là anken CnH2n
na=0,25 mol . áp dụng bảo toàn nguyên tố ooxxi t có nO2=(2nCO2+nH2O)/2=0.75mol
bảo toàn khối lượng => mhh=mCO2+mH2O-mO2=7g
=>Mhh=28 =>anken chính là C2H4

Phương trình điện phân nước: H2O→H2+1/2O2
Hoặc viết dưới dạng nguyên t H2O→2H + O
2mol :1mol
2×1,00792×1,0079đvC x đvC
x=2×1,0079×7,9370
Khối lượng của nguyên tử oxi:2×1,0079×7,9370×1,66005×10−27g=26,55981.10−27kg

Ta có: \(d_{A/H_2}=100\)
\(\Rightarrow M_A=100.2=200\left(g/mol\right)\)
\(\Rightarrow n_A=\dfrac{2}{200}=0,01\left(mol\right)\)
\(n_{CO_2}=\dfrac{4,4}{44}=0,1\left(mol\right)\Rightarrow n_C=0,1\left(mol\right)\)
⇒ Số nguyên tử C trong A là: \(\dfrac{0,1}{0,01}=10\)
\(n_{H_2O}=\dfrac{1,792}{22,4}=0,08\left(mol\right)\Rightarrow n_H=0,08.2=0,16\left(mol\right)\)
⇒ Số nguyên tử H trong A là: \(\dfrac{0,16}{0,01}=16\)
Giả sử n là số nguyên tử O có trong A.
Ta có: 10.12 + 16 + n.16 = 200
⇒ n = 4
Vậy: CTPT của A là C10H16O4.
Bạn tham khảo nhé!
Bảo toàn nguyên tố với C,H :
\(n_C = n_{CO_2} = \dfrac{4,4}{44}= 0,1(mol)\\ n_H = 2n_{H_2O} = 2.\dfrac{1,792}{22,4} = 0,16(mol)\)
Mà :
\(m_O = m_A - m_C - m_H = 2 - 0,1.12 - 0,16 = 0,64(gam)\\ \Rightarrow n_O = \dfrac{0,64}{16} = 0,04(mol)\)
Ta có :
\(n_C: n_H : n_O = 0,1 :0,16 : 0,04 = 5 : 8 : 2\)
Vậy CTPT của A là : \((C_5H_8O_2)_n\)
Mà :
\(M_A = (12.5+8+16.2)n = M_{H_2}.100 = 200(đvC)\\ \Rightarrow n = 2\)
Vậy CTPT của A : \(C_{10}H_{16}O_4\)

a)
nCO2 = 26,4 : 44 = 0,6 mol => nC = 0,6 mol
nH2O = 10,8 : 18 = 0,6 mol => nH = 1,2 mol
nO = 13,44 : 22,4 = 0,6 mol
nC : nH : nO = 0,6 : 1,2 : 0,6 = 1:2:1
=> Công thức đơn giản : (CH2O)n
b) Có 170 < MA < 190
=> 170 < 30n < 190
=> 30n = 180 => n = 6
=> Công thức phân tử : C6H12O6
\(a)n_C = n_{CO_2} = \dfrac{26,4}{44} =0,6(mol)\\ n_{H_2O} = \dfrac{10,8}{18} = 0,6(mol) \Rightarrow n_H = 0,6.2 = 1,2(mol)\\ n_{O_2} = \dfrac{13,44}{22,4} = 0,6(mol) \Rightarrow n_O = 0,6.2 + 0,6 - 0,6.2 = 0,6(mol)\\ n_C : n_H : n_O = 0,6 : 1,2 : 0,6 = 1 : 2 : 1\\ CTĐGN : CH_2O\\ b) CTPT : (CH_2O)_n\\ \Rightarrow 170 < (12 + 2 + 16)n < 190 \\ \Leftrightarrow 5,6 < n < 6,3 \Rightarrow n = 6\\ CTPT : C_6H_{12}O_6\)

1. Theo định luật bảo toàn khối lượng:
m A = m C O 2 + m H 2 O − m O 2
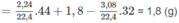
Khối lượng C trong 1,8 g A là: 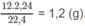
Khối lượng H trong 1,8 g A là: 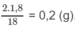
Khối lượng O trong 1,8 g A là : 1,8 - 1,2 - 0,2 = 0,4 (g).
Công thức chất A có dạng C x H y O z :
x : y : z = 0,1 : 0,2 : 0,025 = 4 : 8 : 1
CTĐGN là C 4 H 8 O
2. M A = 2,25.32 = 72 (g/mol)
⇒ CTPT trùng với CTĐGN: C 4 H 8 O .
3. Các hợp chất cacbonyl C 4 H 8 O :
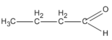 (butanal)
(butanal)
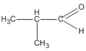 (2-metylpropanal)
(2-metylpropanal)
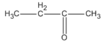 (butan-2-ol)
(butan-2-ol)


5