Hỗn hợp gồm Cu, Fe, Al nặng 10,15g hòa tan bằng HNO3 đặc thoát ra 2,24 lít khí NO2 (đktc) . Nếu hòa tan hỗn hợp bằng HCl dư thoát ra 3,92 lít khí H2(đktc) . Viết phương trình phản ứng và tính % lượng mỗi kim loại
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi x, y ,z là số mol Cu, Fe, Al.
=> 64x + 56y + 27z = 10.15 (1)
Khi cho vào HNO3 đặc nguội thì chỉ có Cu phản ứng
Cu + 4HNO3 --------> Cu(NO3)2 + 2NO2 + 2H2O
x--------------------------------------...
=> 2x = nNO2 = 2.24/22.4 = 0.1 (2)
Khi cho vào HCl thì có Cu không phản ứng
Fe + 2HCl ----------> FeCl2 + H2
y--------------------------------------...
2Al + 6HCl ----------> 2AlCl3 + 3H2
z--------------------------------------...
=> y+3z/2 = nH2 = 3.92/22.4=0.175 (3)
Giải (1), (2), (3) => x=0.05, y=0.1, z=0.05
mCu = 0.05*64=3.2 gam
mFe = 0.1*56=5.6gam
mAl = 0.05*27=1.35 gam
%mCu = 3.2*100/10.15=31.5
%mFe = 5.6*100/10.15=55.2
%mAl = 1.35*100/10.15=13.3.
Source: Yahoo.
Trần Hữu Tuyển giúp mình với, mình giải hệ rồi nhưng kết quả sai

Tính số mol " NO2 ; HNO3 ; H2
đặt n,Cu,Al,Fe lần lượt là x,y,z
=> ...
lập hệ
tự giải nhé !

Khi cho hỗn hợp Al, Fe, Zn vào dung dịch NaOH dư thì chỉ có Zn và Al tham gia phản ứng tạo H2(0,225 mol), phần chất rắn không tan là Fe
Cho Fe phản ứng với lượng dư HCl tạo ra 0,1 mol khí → nFe = nH2 = 0,1 mol → mAl + mZn= 16,7- 5,6 = 11,1
Gọi số mol của Al và Zn lần lượt là x, y
Ta có hệ 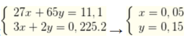
→ %Al = 0 , 05 . 27 16 , 7 ×100% = 8,08 %.
Đáp án D

Gọi x, y lần lượt là số mol NO va NO2
\(\left\{{}\begin{matrix}x+y=0,3\left(mol\right)\\30x+46y=12,2\end{matrix}\right.\)
=> x= 0,1 (mol ) ; y=0,2 (mol)
\(n_{HNO_3}=4n_{NO}+2n_{NO_2}=4.0,1+2.0,2=0,8\left(mol\right)\)
Giả sử: \(\left\{{}\begin{matrix}n_{NO}=x\left(mol\right)\\n_{NO_2}=y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow x+y=\dfrac{6,72}{22,4}=0,3\left(1\right)\)
Theo đề bài, có: 30x + 46y = 12,2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
Theo ĐLBT mol e, có: \(3n_{Fe}+2n_{Cu}=0,1.3+0,2=0,5\left(mol\right)\)
Muối thu được gồm: Fe(NO3)3 và Cu(NO3)2
BTNT Fe, Cu: nFe(NO3)3 = nFe và nCu(NO3)2 = nCu
BTNT N, có: nHNO3 = nNO + nNO2 + 3nFe(NO3)3 + 2nCu(NO3)2
= 0,1 + 0,2 + 0,5 = 0,8 (mol)
Bạn tham khảo nhé!

\(a) m_{Cu} = 9,6(gam)\\ n_{Al} = a(mol) ; n_{Fe} = b(mol)\\ \Rightarrow 27a + 56b = 16,55 -9,6 =6,95(1)\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ n_{H_2} = 1,5a + b = \dfrac{3,92}{22,4} = 0,175(2)\\ (1)(2) \Rightarrow a = 0,05 ; b = 0,1\\ m_{Al} = 0,05.27 = 1,35(gam); n_{Fe} = 0,1.56 = 5,6(gam)\)
\(b) n_{HCl} = 2n_{H_2} = 0,175.2 = 0,35(mol) \Rightarrow m_{HCl} = 0,35.36,5 = 12,775(gam)\)

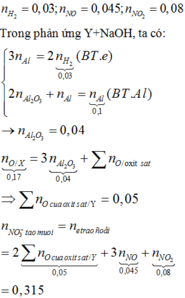
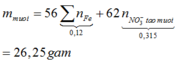
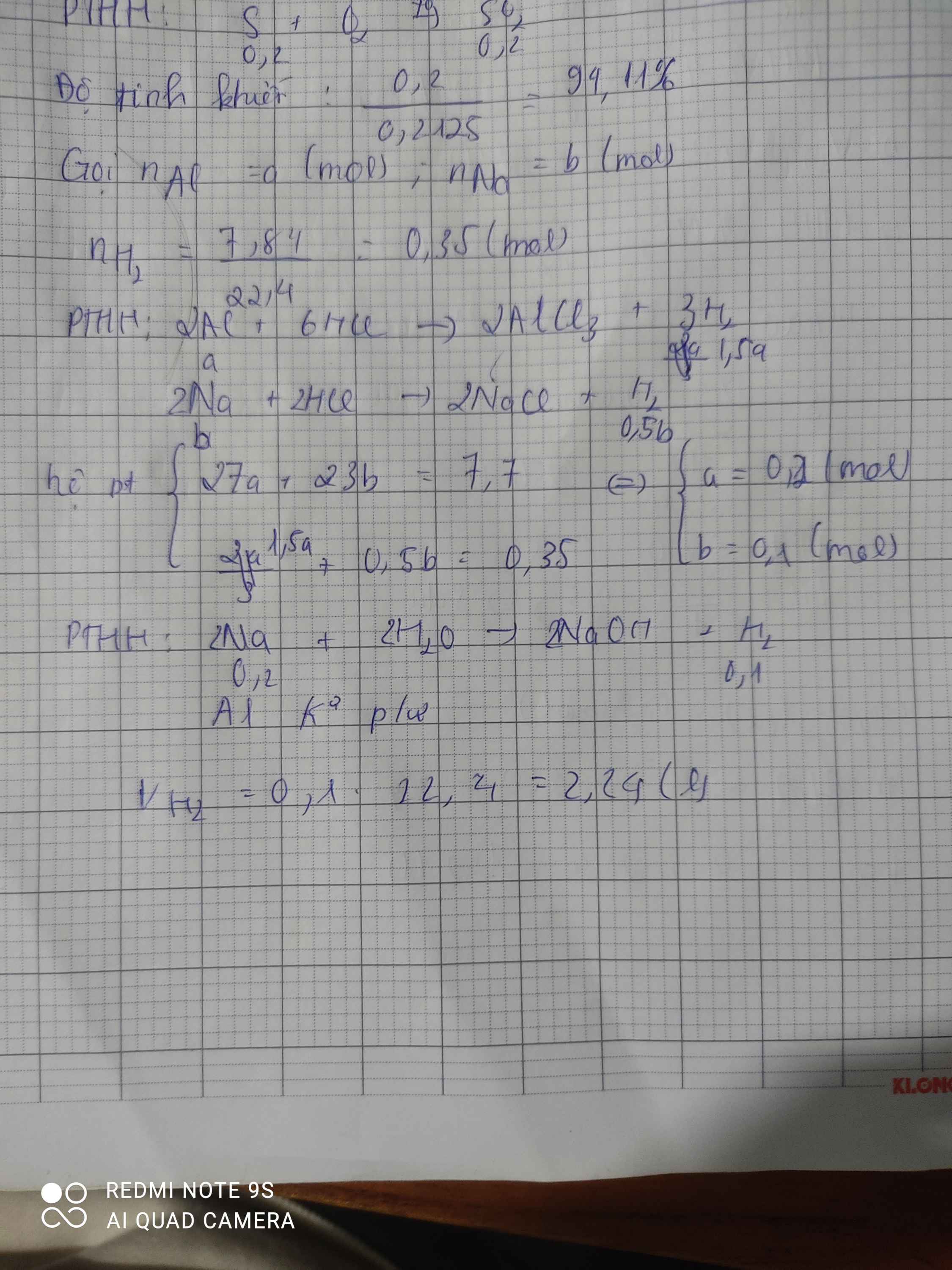

\(PTHH:\text{Cu+4HNO3}\rightarrow\text{Cu(NO3)2+2NO2+2H2O}\)
\(\text{Fe+2HCl}\rightarrow\text{FeCl2+H2}\)
\(\text{2Al+6HCl}\rightarrow\text{2AlCl3+3H2}\)
Gọi a, b lần lượt là số mol của Fe và Al
Ta có :
\(\left\{{}\begin{matrix}\text{nNO2=0,1(mol)}\\\text{nH2=0,175(mol)}\end{matrix}\right.\)
=>nCu=0,05(mol)
=>mCu=0,05x64=3,2(g)
\(\Rightarrow\left\{{}\begin{matrix}\text{56a+27b=6,95}\\\text{a+3b/2=0,175}\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}\text{a=0,1}\\\text{b=0,05}\end{matrix}\right.\)
\(\text{%Cu=3,2/10,15x100=31,53%}\)
\(\text{%Fe=0,1x56/10,15x100=55,17%}\)
\(\text{%Al=13,3%}\)
Cu + 4HNO3 -----> Cu(NO3)2 + 2NO2 + 2H2O
Fe+2HCl---->FeCl2+H2
2Al+6HCl---->2AlCl3+3H2
n\(_{NO2}=\frac{2,24}{22,4}=0,1\left(mol\right)\)
Theo pthh1
n\(_{Cu}=\frac{1}{2}n_{NO2}=0,05\left(mol\right)\)
%m Cu=\(\frac{0,05.64}{10,15}.100\%=31,53\%\)
m\(_{Fe}+m_{Al}=10,15-3,2=6,95\left(g\right)\)
n\(_{H2}=\frac{3,92}{22,4}=0,175\left(mol\right)\)
Gọi n\(_{Fe}=x,n_{Al}=y\)
Theo bài ra ta có pt
\(\)\(\left\{{}\begin{matrix}56x+27y=6,95\\x+1,5x=0,175\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,05\end{matrix}\right.\)
%m\(_{Fe}=\frac{0,1.56}{10,15}.100\%=55,17\text{%}\)
% m Al=100-55,17-31,53=13,3%