1, Cho 2,24 g sắt tác dụng vs dung dịch loãng có chưa 24,5g axit H2SO4. Sau phản ứng thu được muối FeSO4 và khí hidro.
a, tính thể tích H2thu được ở đktc
b, chất nào thừa sau phản ứng thừa bao nhiêu g?
2, Cho 19,5 g kẽm tác dụng vs dung dịch axit HCl. Thu được muối ZnCl2và khí hidro. Hãy cho biết:
a, thể tích H2 thu được ở đktc
b, nếu dùng thể tích khí H2 trên để khử 19,2g Fe2O3 thì thu được nước và sắt. Tính KL sắt thu được?
Gíup Mik Nha

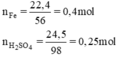

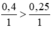 ⇒ Fe dư
⇒ Fe dư
Bài 1
Fe+ H2SO4--->FeSO4 +h2
a) Ta có
n\(_{Fe}=\)\(\frac{2,24}{56}=0,04\left(mol\right)\)
n\(_{H2SO4}=\frac{24,5}{98}=0,25\left(mol\right)\)
=>H2SO4 dư
Theo pthh
n\(_{H2}=n_{Fe}=0,04\left(mol\right)\)
V\(_{H2}=0,04.22,4=0,896\left(l\right)\)
b) Theo pthh
n\(_{H2SO4}=n_{Fe}=0,04\left(mol\right)\)\
n\(_{H2SO4}dư=0,25-0,04=0,21\left(mol\right)\)
m\(_{H2SO4}dư=0,21.98=20,58\left(g\right)\)
nFe= \(\frac{22,4}{56}\) =0,4(mol)
nH2SO4= \(\frac{24,5}{98}\) = 0,25(mol)
PTHH:
2Fe + 3H2SO4 -------> Fe2SO4 + H2 ↑
2mol__ 3mol_________1mol__1mol
0,4___0,25mol
Lập tỉ lệ: \(\frac{0,4}{2}\) > \(\frac{0,25}{3}\)
⇒ Fe dư, H2SO4 hết
a) Theo pt: nH2H2 = nH2SO4H2SO4 = 0,25 mol
⇒VH2=0,25⋅22,4=5,6(l)
b) Sắt thừa sau phản ứng:
Theo pt nFe(pư) = nH2SO4 = 0,25 mol
⇒mFe(pư) = 0 ,25⋅56 = 14(g)⇒mFe(pư) = 0,25⋅56 = 14(g)
mFe (dư) = 22,4 - 14 = 8,4 g