Một hỗn hợp gồm 2 đồng vị có số khối trung bình là 31,1 và tỷ lệ phần trăm của các đồng vị là 90% và 10%. Tổng số hạt cơ bản trong 2 đồng vị là 93. Số hạt không mang điện bằng 0,55 lần số hạt mang điện. Tìm số điện tích hạt nhân và số nơtron trong mỗi đồng vị?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án B
Gọi Z ; N 1 ; N 2 lần lượt là số proton và nơtron của 2 đồng vị đã cho
0 , 9 ( Z + N 1 ) + 0 , 1 ( Z + N 2 ) = 31 , 1 4 Z + ( N 1 + N 2 ) = 93 N 1 + N 2 = 0 , 55 . 4 Z ⇔ Z = 15 N 1 = 16 N 2 = 17

Gọi Z ; N 1 ; N 2 lần lượt là số proton và nơtron của 2 đồng vị đã cho
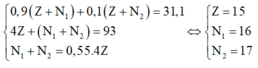
Đáp án B

Đặt đồng vị thứ nhất là ZA1X có số nơtron là N1, đồng vị thứ 2 là ZA2X có số nơtron là N2 (vì 2 đồng vị thuộc cùng 1 nguyên tố nên Z và E như nhau)
+) Số khối trung bình: ¯A=90.A1+10.A2100=0,9.A1+0,1.A2=31,1A¯=90.A1+10.A2100=0,9.A1+0,1.A2=31,1
Vì A = Z + N => 0,9.(Z + N1) + 0,1.(Z + N2) = 31,1
=> 100Z + 90N1 + 10N2 = 3110 (1)
+) Tổng số các hạt trong 2 đồng vị là 93:
=> E + Z + N1 + E + Z + N2 = 93
=> (2Z + N1) + (2Z + N2) = 93 => 4Z + N1 + N2 = 93 (2)
+) Tổng số hạt không mang điện bằng 0,55 lần tổng số hạt mang điện
=> N1 + N2 = 0,55.(Z + E + Z + E)
=> N1 + N2 = 0,55.4Z = 2,2Z (3)
Từ (1), (2) và (3) => Z = 15; N1 = 16; N2 = 17

Tổng hạt trong đồng vị 1 = 2Z + N1
Tổng hạt trong đồng vị 2 = 2Z + N2
—> 4Z + N1 + N2 = 93 và 4Z.0,55 = N1 + N2
—> Z = 15 và N1 + N2 = 33 (1)
—> [90(N1 + 15) + 10(N2 + 15)]/100 = 31,1 (2) (1)(2)
—> N1 = 16 và N2 = 17
Theo đề bài ta có:
\(\\ ĐV_1=A_1;ĐV_2=A_2\\ hpt:\left\{{}\begin{matrix}2p+n_1+2p+n_2=93\\n_1+n_2=0,55\left(2p+2p\right)\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=15\\n_1+n_2=33\left(1\right)\end{matrix}\right.\)
\(\frac{x\%.A_1+y\%.A_2}{100}=31,1\Leftrightarrow\frac{90\left(p+n_1\right)+10\left(p+n_2\right)}{100}=31,1\left(2\right)\)
\(\left(1\right);\left(2\right)\Rightarrow\left\{{}\begin{matrix}n_1=16\\n_2=17\end{matrix}\right.\)

Có
+) 2pY + nY = 43
+) \(2p_Y=\dfrac{28}{15}n_Y\)
=> \(\left\{{}\begin{matrix}p_Y=14\\n_Y=15\end{matrix}\right.\) => AY = 14 + 15 = 29 => AX = 28
=> \(\overline{M}=\dfrac{28.90+29\left(100-90\right)}{100}=28,1\)

Đáp án C
Đồng vị X1 có tổng số hạt là 18 → 2Z1 + N1 = 18
Trong X1 có các loại hạt bằng nhau
→ Z1= N1 =
18
3
= 6 → A1 = Z1 + N1 = 12
Đồng vị X2 có tổng số hạt là 20
→ 2Z2 + N2 = 20
Luôn có Z2=Z1 ( cùng là đồng vị của nguyên tố X)
→ Z2 = 6 → N2 = 8 → A2 = 6 + 8 = 14
Nguyên tử khối trung bình của X là
M X = ( 50 . 12 + 20 . 14 ) / 100 = 13

Đáp án C
Các loại hạt trong X1 bằng nhau → pX1 = nX1 = 18 : 6
Vì X1 và X2 là đồng vị → pX1 =pX2 =6
Tổng số hạt trong X2 là 20 → 2pX2 + nX2 = 20 → nX2 = 8
Số khối của X1 là 12, số khối của X2 là 14
Nguyên tử khối trung bình của X là 50 . 12 + 50 . 14 100 . 100 = 13
