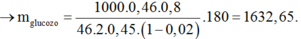Dùng 41g CaC2 hợp H2O thu được 13g C2H2 và 37g Ca(OH)2 .Hỏi phải dùng bao nhiu ml H2O,biết khối lượng riêng của H2O là 1g/ml
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a. PTHH: CaC2 + 2H2O ===> C2H2 + Ca(OH)2
b. Áp dụng định luật bảo toàn khối lượng, ta có:
\(m_{CaC2}+m_{H2O}=m_{C_2H_2}+m_{Ca\left(OH\right)2}\)
\(\Leftrightarrow m_{H2O}=m_{C_2H_2}+m_{Ca\left(OH\right)2}-m_{CaC2}\)
\(\Leftrightarrow m_{H2O}=13+37-41=9\left(gam\right)\)
Áp dụng công thức \(V=\frac{m}{D}\)
=> Thể tích nước cần dùng là:
\(V_{H2O}=\frac{m_{H2O}}{D_{H2O}}=\frac{9}{1}=9\left(ml\right)\)

\(a,\) Cacbon Canxi + Nước → Axetylen + Canxi Hidroxit
\(b,\text{Bảo toàn KL: }m_{CaC_2}+m_{H_2O}=m_{C_2H_2}+m_{Ca\left(OH\right)_2}\\ \Rightarrow m_{H_2O}=13+37-41=9\left(g\right)\\ \Rightarrow V_{H_2O}=\dfrac{9}{1}=9\left(ml\right)\)

PTHH : \(CaC_2+H_2O\rightarrow Ca\left(OH\right)_2+C_2H_2\uparrow\)
Theo ĐLBTKL :
\(m_{CaC2}+m_{H2O}=m_{Ca\left(OH\right)2}+m_{C2H2}\)
\(\Leftrightarrow143,5+m_{H2O}=129,5+45,5\)
\(\Rightarrow m_{H2O}=31,5\left(g\right)\)

Theo đề ta lần lượt có các sơ đồ chuyển hóa sau:
\(CaC_2+2H_2O\rightarrow C_2H_2\uparrow+Ca\left(OH\right)_2\)
(X) (Y) (Z)
\(2C_2H_2+5O_2\underrightarrow{t^o}4CO_2+2H_2O\)
(Y) (T)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
(T) (Z)
Vậy ta có X ; Y ;Z ; T lần lượt là : CaC2 ; C2H2 ; Ca(OH)2 ; CO2
Vậy chọn C

Đáp án: A
Vì V CO2 = V H2O => Este no, mạch hở, đơn chức
nNaOH = 0,03 mol => M este = 22 , 2 0 , 3 = 74 (C3H6O2)
Do đó, hai este là CH3COOCH3 và HCOOC2H5
Khi đốt 0,03 mol C3H6O2, tạo nCO2 = nH2O = 0,09 mol
=> mCO2 + mH2O = 5,58 g