Cho 50ml dung dịch HNO3 a (M) vào 150ml dung dịch Ba(OH)2 0,2M thu được dung dịch X. Nhúng quỳ tím vào dung dịch X thấy quỳ tím chuyển màu xanh . Thêm tiếp từ từ 100ml dung dịch HCl 0,1M vào dung dịch X thấy quỳ tím chuyển về màu tím. Tính a
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Cho 100ml dung dịch Ba(OH)2 0,1M vào 100ml dung dịch HCl 0,1M. Dung dịch thu được sau phản ứng:
A. Làm quỳ tím hoá xanh.
B. Làm quỳ tím hoá đỏ.
C. Phản ứng được với magiê giải phóng khí hydrogen.
D. Không làm đổi màu quỳ tím.
Ba(OH)2 + 2HCl → BaCl2 + 2H2O. H2O là chất trung tính, không làm đổi màu quỳ tím.
Thế 2 chất này phản ứng tỉ lệ mol 1:2 mà số mol thực tế đang là 1:1 thì không có chất dư hay sao em?

nFe=0.1(mol) nCa(OH)2=0.1(mol).Do sau phản ứng một,dd làm quỳ đổi màu đỏ->axit dư
pthh:Fe+H2SO4->FeSO4+H2(1)
H2SO4+Ca(OH)2->CaSO4+2H2O(2)
theo pthh(1):nFe=nH2SO4(1)->nH2SO4(1)=0.1(mol)
theo pthh(2):nCa(OH)2=nH2SO4(2)->nH2SO4(2)=0.1(mol)
Tổng nH2SO4 ở cả 2pt:0.1+0.1=0.2(mol)
mH2SO4=98*0.2=19.6(g)

- Thí nghiệm 1
Ta có: n HCl = 0,05a ( mol ) ; n Ba(OH)2 = 0,05b ( mol )
n H2SO4 = 0,002 ( mol )
PTHH
Ba(OH)2 + 2HCl ======> BaCL2 + 2H2O
0,025a---0,05a
Ba(OH)2 + H2SO4 =====> BaSO4 + H2O
0,002 -------0,002
theo pthh: 0,025a + 0,002 = 0,05b ( 1 )
- Thí nghiệm 2
Ta có: n HCl = 0,1a ( mol ) ; n Ba(OH)2 = 0,05b ( mol )
n NaOH = 0,002 ( mol )
PTHH
Ba(OH)2 + 2HCL =====> BaCl2 + 2H2O
0,05b------0,1b
NaOH + HCL =====> NaCL + H2O
0,002---0,002
theo pthh : 0,1b + 0,002 = 0,1a ( 2 )
Từ ( 1 ) và ( 2 ) sauy ra a = 0,12 ( mol ) ; b = 0,1 ( mol )

Chọn D
HCl tác dụng với NaOH tạo ra muối và không làm đổi màu quỳ tím

Đáp án B
nH+ = 0,05 mol; nOH- = 0,07 mol
H+ + OH- → H2O
Ta thấy H+ hết, OH- dư nên nhúng quỳ tím vào Y thì quỳ tím chuyển thành màu xanh.

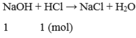
Sau phản ứng dung dịch thu được chỉ chứa NaCl, vậy dung dịch sau phản ứng không làm quỳ tím đổi màu.
Chọn đáp án C

PTPU
Ba(OH)2+ 2HNO3\(\rightarrow\) Ba(NO3)2+ 2H2O (1)
,0,025........0,05......................................... mol
Ba(OH)2+ 2HCl\(\rightarrow\) BaCl2+ 2H2O (2)
..0,005.........0,01.......................... mol
có: nBa(OH)2= 0,2. 0,15= 0,03( mol)
nHCl= 0,1. 0,1= 0,01( mol)
vì dd X làm quỳ tím chuyển xanh nên Ba(OH)2 còn dư sau khi pư với HNO3
thêm tiếp 0,01 mol HCl vào X thì quỳ tím chuyển về màu tím nên 0,01 mol HCl trung hòa vừa đủ với Ba(OH)2 còn dư
\(\Rightarrow\) nBa(OH)2 dư= 0,01. \(\frac{1}{2}\)= 0,005( mol)
\(\Rightarrow\) nBa(OH)2 pư(1)= 0,03- 0,005= 0,025( mol)
\(\Rightarrow\) nHNO3= 0,025. 2= 0,05( mol)
\(\Rightarrow\) CM HNO3= a= \(\frac{0,05}{0,05}\)= 1( M)