Bài 2: Cho 16g một oxit kim loại tác dụng với 120ml dung dịch HCl thu được 32,5g muối khăng. Tìm công thức oxit kim loại và nồng độ mol dung dịch đã dùng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H_2SO_4}=\dfrac{147.20\%}{98}=0,3\left(mol\right)\\ Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ n_{H_2}=n_{axit}=0,3\left(mol\right)\\ Đặt:A_2O_3\\ A_2O_3+3H_2\rightarrow\left(t^o\right)2A+3H_2O\\ n_{oxit}=\dfrac{n_{H_2}}{3}=\dfrac{0,3}{3}=0,1\left(mol\right)\\ M_{oxit}=\dfrac{16}{0,1}=160\left(\dfrac{g}{mol}\right)=2M_A+48\\ \Rightarrow M_A=56\left(\dfrac{g}{mol}\right)\\ \Rightarrow A:Sắt\left(Fe=56\right)\\ \Rightarrow Oxit:Fe_2O_3\)
cho 16g oxit sắt tác dụng với 120ml dd HCL thì thu được 32,5g muối khan. Tính nồng độ mol cua dd HCL

PTPƯ:
FexOy + 2yHCI -------------> xFeCI2y/x +yH2O
1mol ----------------------------> xmol
16/(56x +16y)mol-------------> 32,5/(56 + 71y/x)
=> 16x/(56x + 16y) = 32,5/(56 + 71y/x)
=> 896x +1136y = 1820x + 520y
=>616y = 924x
=> x/y = 2/3
Vậy CT của oxít sắt là Fe2O3
=>Fe2O3+3H2SO4->Fe2(SO4)3+3H2O
0,1---------------0,3
n Fe2O3=0,1 mol
=>CMHCl=\(\dfrac{0,3}{0,12}\)=2,5M

\(a,PTHH:2Na+2H_2O\rightarrow2NaOH+H_2\\ n_{Na}=\dfrac{2,3}{23}=0,1mol\\ n_{NaOH}=0,1.2=0,2mol\\ C_{M_{NaOH}}=\dfrac{0,2}{0,5}=0,4M\\ b,oxit.kl:RO\\ n_{RO}=\dfrac{2,4}{R+16}mol\\ n_{HCl}=\dfrac{30.7,3}{100.36,5}=0,06mol\\ RO+2HCl\rightarrow RCl_2+H_2O\\ \Rightarrow\dfrac{2,4}{R+16}=0,06:2\\ \Leftrightarrow R=64,Cu\)

Gọi n M 2 O = a thì nMOH = 2a, mỗi phần có nMOH = a
Khi nHCl = 0,095 thì dung dịch sau phản ứng làm quỳ tím hóa xanh nên MOH dư => a > 0,095
Khi nHCl = 0,11 thì dung dịch sau phản ứng làm quỳ tím hóa đỏ nên HCl dư => a < 0,11
Có 0,095 < a < 0,11
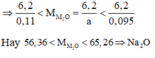
Đáp án B

Bài 2: Mg + 2HCl → MgCl2 + H2 ↑
Số mol của Mg là: 2,4 : 24 = 0,1 mol
Đổi: 100 ml = 0,1 lít
Số mol của HCl là: 1,5 . 0,1 = 0,15 mol
So sánh : \(0,1>\frac{0,15}{2}\) Mg dư ; tính theo HCl
a) Số mol của MgCl2 là: 0,15 . 1/2 = 0,075 (mol)
Khối lượng của MgCl2 sau phản ứng là: 0,075 . 95 = 7,125 gam
Số mol của H2 là: 0,075 mol => mH2 = 0,075 . 2 = 0,15 gam
b) Nồng độ mol muối của Mg là: \(\frac{0,075}{0,1}=0,75M\)
( Vì thể tích dung dịch sau phản ứng thay đổi k đáng kể )

Gọi kim loại cần tìm là A
công thức oxit là : AO
Coi số mol HCl bằng 1 mol
Ta có phương trình:
AO + 2HCl = ACl2 + H2O
0,5 1 0,5 (mol)
=> mAO = (A+16).0,5 (g)
mdd HCl = 365 (g)
=> mdd sau phản ứng = 0,5A + 373
mmuối ACl2 = 0,5.(A+71) (g)
Có C%dd ACl2 = 12,34%
=>0,5.100.(A+71) = 12,34 .(0,5A+373)
=>A = 24 => A là Mg
Gọi kim loại cần tìm là A
công thức oxit là : AO
Coi số mol HCl bằng 1 mol
Ta có phương trình:
AO + 2HCl = ACl2 + H2O
0,5 1 0,5 (mol)
=> mAO = (A+16).0,5 (g)
mdd HCl = 365 (g)
=> mdd sau phản ứng = 0,5A + 373
mmuối ACl2 = 0,5.(A+71) (g)
Có C%dd ACl2 = 12,34%
=>0,5.100.(A+71) = 12,34 .(0,5A+373)
=>A = 24 => A là Mg

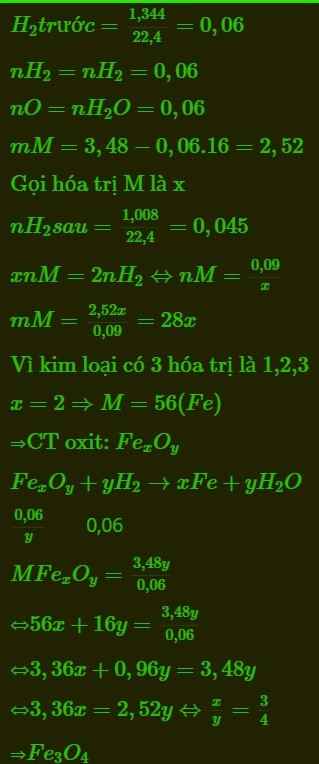
gọi oxit cần tìm là R2Ox
PTPU
R2Ox+ 2xHCl\(\rightarrow\) 2RClx+ xH2O
có: nR2Ox= \(\frac{16}{2R+16x}\)( mol)
theo PTPU có: nRClx= 2nR2Ox= 2. \(\frac{16}{2R+16x}\)= \(\frac{32}{2R+16x}\)( mol)
\(\Rightarrow\)\(\frac{32}{2R+16x}\) . ( R+ 35,5x)= 32,5
\(\Rightarrow\) 32.( R+ 35,5x)= 32,5.( 2R+ 16x)
\(\Rightarrow\) 32R+ 1136x= 65R+ 520x
\(\Rightarrow\) 33R= 616x
\(\Rightarrow\) \(\frac{R}{x}\)= \(\frac{616}{33}\)\(\approx\) 18,67
ta có bảng
\(\Rightarrow\) CTHH: Fe2O3
\(\Rightarrow\) nFe2O3= \(\frac{16}{160}\)= 0,1( mol)
thep PTPU có: nHCl= 6nFe2O3= 0,6( mol)
\(\Rightarrow\) CM HCl= \(\frac{0,6}{0,12}\)= 5M
Cảm ơn bạn !!!