1 cho sản phẩm tạo thành khi nung nóng hỗn hợp gồm 5,6g bột Fe và 1,6g bột lưu huỳnh vào 500ml dung dịch HCl dư thì thu đc một hỗn hợp khí bay ra và dung dịch A ( các phản ứng xảy ra hoàn toàn)
a)tính thành phần % về thể tích của hỗn hợp khí
b)để trung hòa HCl còn thừa trong dung dịch A người ta phải dung 125ml dung dịch NaOH 0,1M . tính nồng độ mol/l của dung dịch HCl đã dùng
2. nung nóng 2,4 g hỗn hợp bột kim loại Mg và Fe trong bột S dư,chất rắn thu đc sau phản ứng hòa tan hoàn toàn bằng dung dịch H2SO4 loãng thấy có 1,344l khí thoát ra ở đktc . xác định khối lượng mỗi kim loại trong hỗn hợp ban đầu
3. cho 0,83 g hỗn hợp bột sắt và bột nhôm tác dụng vừa đủ với 0,8g bột lưu huỳnh
a) viết PTHH
b)tính khối lượng mỗi kim loại trong hỗn hợp ban đầu

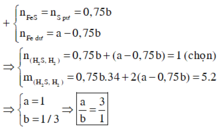
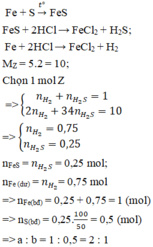
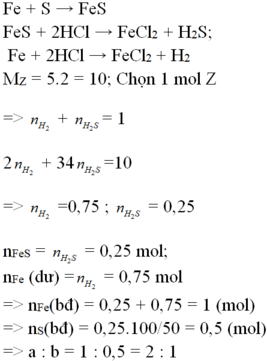
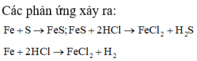
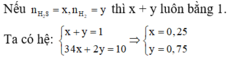
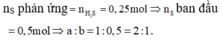
nFe= 5.6/56= 0.1 mol
nS= 1.6/32=0.05 mol
Fe + S -to-> FeS
0.05__0.05____0.05
hh X gồm: 0.05 mol Fe dư
0.05 mol FeS
Fe + 2HCl --> FeCl2 + H2 (1)
0.05__0.1____0.05___0.05
FeS + 2HCl --> FeCl2 + H2S (2)
0.05__0.1_____0.05____0.05
Hỗn hợp khí: 0.05 mol H2
0.05 mol H2S
dd A: 0.1 mol FeCl2 , HCl dư
Vì: %thể tích tương ứng với % số mol nên:
%VH2=%VH2= 0.05/0.1 *100= 50%
nNaOH= 0.125*0.1=0.0125 mol
NaOH + HCl --> NaCl + H2O(3)
0.0125___0.0125
nHCl (1,2,3)= 0.1+0.1+0.0125=0.2125 mol
CM HCl = 0.2125/0.5=0.425M
2/ Đặt: nMg= x mol
nFe= y mol
Mg + S -to-> MgS
x___________x
Fe + S -to-> FeS
y__________y
mhh= 24x + 56y = 2.4 g (1)
MgS + H2SO4 --> MgSO4 + H2S
x________________________x
FeS + H2SO4 --> FeSO4 + H2S
y_______________________y
nH2S= x + y = 1.344/22.4=0.06 mol (2)
Giải (1) và (2):
x= y= 0.03
mMg= 0.03*24=0.72g
mFe= 0.03*56=1.68g